2019内蒙古高二上学期人教版(2019)高中化学期中考试
| 1. | 详细信息 |
|
在一密闭容器中充入一定量的N2和H2,经测定反应开始后的2s内氢气的平均速率:v(H2)=0.45mol/(L•s),则2s末NH3的浓度为 A.0.45mol/L B.0.50mol/L C.0.55mol/L D.0.60mol/L
|
|
| 2. | 详细信息 |
|
将 4 mol A 气体和 2 mol B 气体在 2 L 的容器中混合并在一定条件下发生如下反应 2A(g)+B(g) ② 用物质 B 表示的反应的平均速率为 0.6 mol·(L·s)-1 ③ 2 s 时物质 A 的转化率为70% ④ 2 s 时物质 B 的浓度为 0.7 mol·L-1 其中正确的是 A.①③ B.①④ C.②③ D.③④
|
|
| 3. | 详细信息 |
|
已知反应:A(g)+2B(g)=2C(g)+D(g)在四种不同情况下的化学反应速率分别为:①v (A)=0.15mol/(L·s) ②v(B)=0.4mol/(L·s) ③v(C)=0.3mol/(L·s) ④v(D)=0.5mol/(L·s)则四种情况下反应进行的快慢顺序为 A.②>④>③>① B.④>③=②>① C.④>②>③=① D.④>③>①>②
|
|
| 4. | 详细信息 |
|
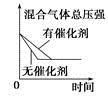
反应C(s)+H2O(g) A.②④ B.①③ C.③④ D.①④
|
|
| 5. | 详细信息 | ||||||||||
|
在一定温度下,将气体X和气体Y各2 mol充入某10 L恒容密闭容器中,发生反应X(g)+Y(g)
下列说法正确的是 A.反应前2 min 的平均速率v(Z)=3.0xl0-2 mol• L-1min-1 B.该温度下此反应的平衡常数K=64 C.平衡后其他条件不变,再充入2 mol Z,新平衡时X的体积分数增大 D.反应进行到10 min时保持其他条件不变,降低温度,反应达到新平衡前v(逆)>v(正)
|
|||||||||||
| 6. | 详细信息 | |||||||||||||||
|
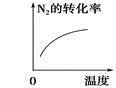
对于可逆反应N2(g)+3H2(g)
|
||||||||||||||||
| 7. | 详细信息 |
|
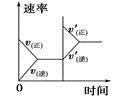
在恒温恒容容器中发生反应2SO2(g)+O2(g) A.容器内压强不再变化,说明反应达到平衡状态 B.当c(SO2):c(O2)=1:2且保持不变,能表明反应达到平衡状态 C.加入合适的催化剂可显著增大反应速率 D.达到平衡状态时,相同时间内,每消耗2molSO3的同时生成1molO2
|
|
| 8. | 详细信息 |
|
下列叙述正确的是 A.中和等体积等浓度的醋酸和盐酸,醋酸需要的氢氧化钠溶液更多 B.pH=3的醋酸溶液,稀释至10倍后pH=4 C.pH=3的醋酸溶液与pH=11的氢氧化钠溶液等体积混合后pH>7 D.pH均为3的醋酸和盐酸分别与足量Zn反应,醋酸产生的H2多
|
|
| 9. | 详细信息 |
|
物质的量浓度相同的以下溶液:①NH4HSO4 ②(NH4)2CO3 ③NH4Fe(SO4)2 ④NH4NO3 ⑤CH3COONH4,c(NH4+)由大到小的顺序为 A.②①③④⑤ B.③①④②⑤ C.①③④⑤② D.②①④⑤③
|
|
| 10. | 详细信息 |
|
下列各化合物中,均为弱电解质的一组是 A.H2CO3 Ba(OH)2 K2S H3PO4 B.FeCl3 HCl C2H5OH NH4Cl C.CH3COOH H2CO3 Cu(OH)2 H2O D.HCl KNO3 H2CO3 H2SO4
|
|
| 11. | 详细信息 |
|
室温下,下列各组离子在指定溶液中一定能大量共存的是) ①pH=0的溶液:Na+、I-、NO3-、SO42- ②pH=12的溶液中:CO32-、Na+、NO3-、S2-、SO32- ③水电离H+浓度c(H+)=10-12 mol/L-1溶液中:Cl-、CO32-、NO3-、NH4+、SO32- ④加入Mg能放出H2的溶液中:Mg2+、NH4+、Cl-、K+、SO42- ⑤使石蕊变红的溶液中:Fe2+、MnO4-、NO3-、Na+、SO42- ⑥中性溶液中:Fe3+、Al3+、NO3-、Cl-、 A.②④ B.只有② C.①②⑤ D.①②⑥
|
|
| 12. | 详细信息 |
|
25℃时,水的电离达到平衡状态,下列叙述正确的是 A.向水中加入稀氨水,水的电离平衡将逆向移动,氢氧根离子浓度降低 B.向水中加入少量固体硫酸氢钠,氢离子浓度增大,Kw不变 C.向水中加入少量固体醋酸钠,水的电离平衡逆向移动,氢离子浓度降低 D.将水加热,Kw增大,水的电离平衡不移动,pH不变
|
|
| 13. | 详细信息 |
|
对于MgCl2 溶液和 FeCl3溶液的有关说法,不正确的是 A.配制FeCl3溶液时,为了防止溶液出现浑浊,可以向溶液中滴入少量盐酸 B.为了除去MgCl2酸性溶液中的FeCl3,可在加热搅拌的条件下加入MgCO3,过滤后,再向滤液中加入适量盐酸 C.向FeCl3溶液加FeCl3固体,水解平衡正向移动,FeCl3水解程度增大 D.向FeCl3溶液加水,溶液颜色变浅,FeCl3水解程度增大
|
|
| 14. | 详细信息 |
|
常温下,用0.1000 mol·L-1 NaOH溶液滴定20.00 mL 0.1000 mol·L-1 CH3COOH溶液所得滴定曲线如下图。下列说法正确的是
A.点①所示溶液中:c(CH3COO-)+c(OH-)=c(Na+)+c(H+) B.点②所示溶液中:c(Na+)=c(CH3COOH)+c(CH3COO-) C.点③所示溶液中:NaOH与CH3COOH恰好完全中和,溶液呈中性 D.在0.1000 mol·L-1 CH3COOH溶液中,由水电离出来的c(H+)= 10-13 mol·L-1
|
|
| 15. | 详细信息 |
|
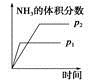
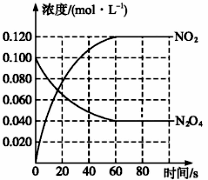
将1mol N2O4气体充入容积为10L的密闭容器中,回答下列问题:
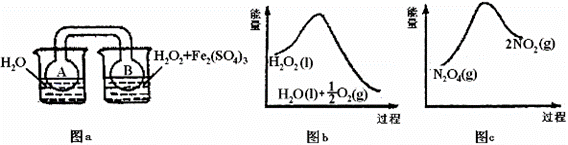
(1)100 ℃时,体系中各物质浓度随时间变化如上图所示。在0~60 s时段,反应速率v(N2O4)为________________;反应N2O4(g) (2)当反应达到平衡时,对于反应N2O4(g) ①气体颜色加深 ②N2O4的体积分数增加 ③恒温恒压充入He ④单位时间内消耗N2O4和NO2的物质的量之比等于1:2 (3)若起始时充入1molNO2气体,建立如下平衡2NO2(g) (4)如下图a所示,连通的玻璃瓶中充入NO2气体,建立如下平衡2NO2(g)
|
|
| 16. | 详细信息 |
|
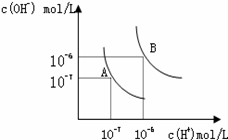
水的电离平衡曲线如图所示。
(1)若以A点表示25℃时水在电离平衡时的离子浓度, 当温度升到100℃时,水的电离平衡状态到B点,则此时水的离子积从_____________增加到_____________。 (2)保持100℃的恒温,将pH=8的Ba(OH)2溶液与pH=5的稀盐酸混合,欲使混合溶液pH=7,则Ba(OH)2与盐酸的体积比为____________________。 (3)物质的量浓度相同的醋酸和氢氧化钠溶液混合后,溶液中醋酸根离子和钠离子浓度相等,则混合后溶液呈________(填“酸性”,“中性”或“碱性”),醋酸体积____________氢氧化钠溶液体积。(填“ >” 或“=”或“<” )。 (4)已知某溶液中只存在OH-、H+、NH4+、Cl-四种离子,某同学推测该溶液中各离子浓度大小顺序可能有如下四种关系: A.c(Cl-)>c(NH4+)>c(H+)>c(OH-) B.c(Cl-)>c(NH4+)>c(OH-)>c(H+) C.c(Cl-)>c(H+)>c(NH4+)>c(OH-) D.c(NH4+)>c(Cl-)>c(OH-)>c(H+) ①若溶液中只溶解了一种溶质,上述离子浓度大小关系中正确的是(选填字母)________。 ②若上述关系中D是正确的,则溶液中的溶质为____________________; ③若向氨水中加入稀硫酸至溶液的pH=7,此时c(NH4+)=a mol/L,则c(SO42-)= _____
|
|
| 17. | 详细信息 |
|
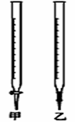
Ⅰ、某学生用0.2000 mol·L-1的标准NaOH溶液滴定未知浓度盐酸,其操作可分为如下几步: ①用蒸馏水洗涤碱式滴定管,并注入NaOH溶液至“0”刻度线以上 ②固定好滴定管并使滴定管尖嘴充满液体 ③调节液面至“0”或“0”刻度线稍下,并记下读数 ④量取20.00mL待测液注入用待测液润洗过的锥形瓶中,并加入3滴甲基橙溶液 ⑤用标准液滴定至终点,记下滴定管液面读数 请回答: (1)以上步骤有错误的是(填编号)________。 (2)用标准NaOH溶液滴定时,应将标准NaOH溶液注入______中。(从图中选填“甲”或“乙”)
(3)滴定时,左手控制滴定管,右手摇动锥形瓶,眼睛注视_______________。 (4)判断到达滴定终点的现象是:锥形瓶中溶液_________________________。 (5)下列操作会引起实验结果偏大的是:______(填编号) A.滴定终点时,有一滴标准液悬挂在滴定管尖嘴处 B.观察计数时,滴定前俯视,滴定后仰视 C.锥形瓶先用蒸馏水洗涤后,未用待测液润洗 D.用酸式滴定管量取液体时,释放液体前滴定管前端有气泡,之后消失 E.滴定时振荡锥形瓶有溶液飞溅出去 F.配制标准NaOH溶液定容时仰视观察刻度线 Ⅱ.(6)为了检验某残留物中铁元素的含量,先将残留物预处理,把铁元素还原成Fe2+,再用KMnO4标准溶液在酸性条件下进行氧化还原滴定,写出滴定过程中反应的离子方程式:________________________________________。KMnO4应装在___________滴定管中(填“酸式”或“碱式”)滴定前是否要滴加指示剂?___(填“是”或“否”),滴定终点的判断方法:_____________________________。 (7)某酸性CuCl2溶液中含少量的FeCl3,为制得纯净CuCl2溶液,宜加入______________调至溶液pH=4,使Fe3+转化为Fe(OH)3沉淀,此时溶液中的c(Fe3+)=________________。[Fe(OH)3的Ksp=2.6×10-39]
|
|