冲刺2021高考化学押题训练(九)水溶液中的离子平衡
教材版本:化学
试卷分类:化学高考
试卷大小:1.0 MB
文件类型:.doc 或 .pdf 或 .zip
发布时间:2024-05-01
授权方式:免费下载
下载地址:点此下载
以下为试卷部分试题预览
| 1. 单选题 | |
|
下列有关说法正确的是( )
A . 氧化钾溶于水能导电,所以氧化钾是电解质
B . 强电解质一定是含有离子键,弱电解质中一定含弱极性共价键
C . 酸性氧化物不一定是非金属氧化物,碱性氧化物都是金属氧化物
D . 纳米铁粉分散在水中形成胶体,可以通过吸附的方式高效地去除被污染水体中的
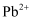 、 、  、 、 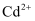 、 、  等重金属离子 等重金属离子
|
|
| 2. 单选题 | |
|
根据下列图示所得出的结论错误的是( )
A . 图甲表示冰醋酸的导电能力随着加水体积变化关系图,若用湿润的
 试纸测量a点的 试纸测量a点的  ,则测量结果可能偏小
B . 图乙表示 ,则测量结果可能偏小
B . 图乙表示  的盐酸溶液加水稀释至 的盐酸溶液加水稀释至  随 随  的变化关系图
C . 图丙表示一定温度下三种碳酸盐 的变化关系图
C . 图丙表示一定温度下三种碳酸盐  的沉淀溶解平衡曲线图 的沉淀溶解平衡曲线图  ,则有 ,则有  、 、 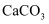 、 、 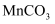 的 的  依次减小
D . 图丁表示 依次减小
D . 图丁表示  盐酸滴定 盐酸滴定  溶液的滴定曲线 溶液的滴定曲线
|
|
| 3. 多选题 | |
|
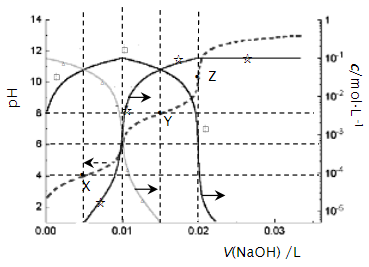
25℃时,0.10 L某二元弱酸H2A用1.00 mol·L-1NaOH溶液调节其pH,溶液中H2A、HA-及A2-的物质的量浓度变化如图所示:
下列说法错误的是( )
A . H2A的Ka1=1×10-4
B . 溶液在X点和Z点时水的电离程度相同
C . 在Y点时,c(Na+)>3c(A2-)
D . 0.1 mol·L-1NaHA溶液中:c(Na+)>c(HA-)>c(H2A)>c(A2-)
|
|
| 4. 单选题 | ||||||||||||||||
|
室温下,通过下列实验探究FeCl3水解反应[FeCl3(黄色)+3H2O⇌Fe(OH)3(红褐色)+3HCl]的条件。
下列有关说法正确的是( )
A . 实验1得到的溶液中有c(Cl-)>c(Fe3+)>c(OH-)>c(H+)
B . 实验2中FeCl3水解反应的化学平衡常数变小
C . 实验3得到的溶液中有3c(Fe3+)+c(H+)=c(NH3·H2O)+c(Cl-)+c(OH-)
D . 实验4中反应的离子方程式为Fe3++
 +H2O=Fe(OH)3↓+CO2↑ +H2O=Fe(OH)3↓+CO2↑
|
||||||||||||||||
| 5. 单选题 | |
|
反应CO2 + 2NaOH = Na2CO3 + H2O可用于捕捉废气中的CO2 , 下列表示或说法正确的是( )
A . NaOH的电子式:
 C . CO
C . CO  的空间构型:平面三角形
D . CO 的空间构型:平面三角形
D . CO  的水解方程式:CO 的水解方程式:CO  +2H2O +2H2O  H2CO3+2OH− H2CO3+2OH−
|
|
| 6. 单选题 | ||||||||||||||||
|
室温下,进行下列实验,根据实验操作和现象所得的结论正确的是( )
A . A
B . B
C . C
D . D
|
||||||||||||||||
| 7. 多选题 | |
|
常温下,以酚酞作指示剂,用0.1 mol/L的NaOH溶液滴定20.00 mL 0.1 mol/L的二元酸H2A溶液。溶液中pH、分布系数δ随滴加NaOH溶液体积V(NaOH)的变化关系如图所示。[A2−的分布系数为
 ]( ) ]( )
A . 当V(NaOH)=0 mL时,c(HA-)+c(A2-)=0.1 mol/L
B . 当V(NaOH)=20.00 mL时,c(Na+)>c(HA-)+2c(A2-)
C . 常温下,A2-的水解常数值为1.0×10-12
D . 当V(NaOH)=30.00 mL时,c(HA-)+c(H+)=c(A2-)+c(OH-)
|
|
| 8. 综合题 | |
 是一种重要的无机化工原料,可用于制备多晶材料、光学玻璃。现有如下两种途径可以制得。 是一种重要的无机化工原料,可用于制备多晶材料、光学玻璃。现有如下两种途径可以制得。
|
|
| 9. 综合题 | |
|
草酸亚铁晶体(FeC2O4·2H2O)是一种重要的化工原料,广泛应用于涂料、染料、玻璃器皿等的着色剂,也可用于新型电池材料,感光材料的生成。实验室制备草酸亚铁晶体的一种流程如下:
|
|
| 10. 单选题 | |
|
常温下,向含少量盐酸的0.1mol/L的CrCl3溶液中逐滴滴加NaOH溶液,所加NaOH溶液的体积与溶液pH变化如图所示。
已知:Cr(OH)3为灰绿色的沉淀,当Cr3+浓度为10-5mol/L时,可认为沉淀完全,碱过量时生成[Cr(OH)4]-离子。下列说法正确的是( )
A . AB段发生反应的离子方程式为:
 B . A到D过程中,溶液中水的电离程度先减小后增大
C . 当溶液pH=5时,
B . A到D过程中,溶液中水的电离程度先减小后增大
C . 当溶液pH=5时,  D . D点溶液中
D . D点溶液中 
|
|
- 2017年江西省高考化学模拟试卷
- 2016年山东省菏泽市成武一中高考化学三模试卷
- 备考2018年高考化学一轮基础复习:专题14 原子结构 核外电子排布
- 湖南省永州市2019-2020学年高一下学期化学期末考试试卷
- 陕西省延安市实验中学大学区校际联盟2016-2017学年高二上学期化学期末考试试卷(A卷)
- 湖南师大附中2017-2018学年高考理综-化学一模考试试卷
- 江苏省南京市2019-2020学年高二下学期化学期末考试试卷
- 2016-2017学年安徽省滁州市天长市高二下学期期中化学试卷
- 黑龙江省哈尔滨市宾县第一中学2019-2020学年高二上学期化学期末考试试卷
- 四川省成都市新都区2019-2020学年高一下学期化学期末考试试卷
- 四川省内江市2017-2018学年高三理综-化学三模考试试卷
- 广西北流市实验中学2019-2020学年高二下学期化学期中考试试卷


 溶液(含
溶液(含  和
和  等杂质)为原料制备
等杂质)为原料制备 
 ,加热、保持溶液温度在
,加热、保持溶液温度在  ,将
,将  沉淀,反应后滤液的
沉淀,反应后滤液的  ,将
,将  沉淀,写出该反应的离子方程式。
沉淀,写出该反应的离子方程式。 (
(  )转变为氢氧化物沉淀的
)转变为氢氧化物沉淀的  的原因是。
的原因是。
 ,同时产生气体,写出生成
,同时产生气体,写出生成  的化学方程式。
的化学方程式。
 ,搅拌溶解。
,搅拌溶解。  溶解
溶解  ,充分反应后过滤、得
,充分反应后过滤、得  溶液,浓缩得
溶液,浓缩得  ,
,  条件下煅烧得
条件下煅烧得  的原因:(
的原因:( 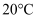 时,
时,  )。
)。

 ,自身被还原为Mn2+。
,自身被还原为Mn2+。 部分会被还原为MnO2 , 则达到滴定终点时,消耗KMnO4溶液的体积(填“偏大”、“偏小”或“不影响”)。
部分会被还原为MnO2 , 则达到滴定终点时,消耗KMnO4溶液的体积(填“偏大”、“偏小”或“不影响”)。



