2017е№ҙй«ҳиҖғзҗҶз»јзңҹйўҳиҜ•еҚ·пјҲеҢ–еӯҰйғЁеҲҶпјүпјҲж–°иҜҫж Үв… еҚ·пјү
ж•ҷжқҗзүҲжң¬пјҡеҢ–еӯҰ
иҜ•еҚ·еҲҶзұ»пјҡеҢ–еӯҰй«ҳиҖғ
иҜ•еҚ·еӨ§е°Ҹпјҡ1.0 MB
ж–Ү件зұ»еһӢпјҡ.doc жҲ– .pdf жҲ– .zip
еҸ‘еёғж—¶й—ҙпјҡ2024-05-01
жҺҲжқғж–№ејҸпјҡе…Қиҙ№дёӢиҪҪ
дёӢиҪҪең°еқҖпјҡзӮ№жӯӨдёӢиҪҪ
д»ҘдёӢдёәиҜ•еҚ·йғЁеҲҶиҜ•йўҳйў„и§Ҳ
| 1. еҚ•йҖүйўҳ | |
|
дёӢеҲ—з”ҹжҙ»з”Ёе“Ғдёӯдё»иҰҒз”ұеҗҲжҲҗзәӨз»ҙеҲ¶йҖ зҡ„жҳҜпјҲгҖҖгҖҖпјү
A . е°јйҫҷз»і
B . е®Јзәё
C . зҫҠз»’иЎ«
D . жЈүиЎ¬иЎЈ
|
|
| 2. еҚ•йҖүйўҳ | |
|
гҖҠжң¬иҚүиЎҚд№үгҖӢдёӯеҜ№зІҫеҲ¶з ’йңңиҝҮзЁӢжңүеҰӮдёӢеҸҷиҝ°пјҡвҖңеҸ–з ’д№Ӣжі•пјҢе°Ҷз”ҹз ’е°ұзҪ®зҒ«дёҠпјҢд»ҘеҷЁиҰҶд№ӢпјҢд»Өз ’зғҹдёҠйЈһзқҖиҰҶеҷЁпјҢйҒӮеҮқз»“зҙҜ然дёӢеһӮеҰӮд№іпјҢе°–й•ҝиҖ…дёәиғңпјҢе№ізҹӯиҖ…ж¬Ўд№ӢпјҺвҖқж–Үдёӯж¶үеҸҠзҡ„ж“ҚдҪңж–№жі•жҳҜпјҲгҖҖгҖҖпјү
A . и’ёйҰҸ
B . еҚҮеҚҺ
C . е№ІйҰҸ
D . иҗғеҸ–
|
|
| 3. еҚ•йҖүйўҳ | |
|
е·ІзҹҘ
A . bзҡ„еҗҢеҲҶејӮжһ„дҪ“еҸӘжңүdе’ҢpдёӨз§Қ
B . bгҖҒdгҖҒpзҡ„дәҢж°Ҝд»Јзү©еқҮеҸӘжңүдёүз§Қ
C . bгҖҒdгҖҒpеқҮеҸҜдёҺй…ёжҖ§й«ҳй”°й…ёй’ҫжә¶ж¶ІеҸҚеә”
D . bгҖҒdгҖҒpдёӯеҸӘжңүbзҡ„жүҖжңүеҺҹеӯҗеӨ„дәҺеҗҢдёҖе№ійқў
|
|
| 4. еҚ•йҖүйўҳ | |
|
е®һйӘҢе®Өз”ЁH2иҝҳеҺҹWO3еҲ¶еӨҮйҮ‘еұһWзҡ„иЈ…зҪ®еҰӮеӣҫжүҖзӨәпјҲZnзІ’дёӯеҫҖеҫҖеҗ«жңүзўізӯүжқӮиҙЁпјҢз„ҰжҖ§жІЎйЈҹеӯҗй…ёжә¶ж¶Із”ЁдәҺеҗёж”¶е°‘йҮҸж°§ж°”пјүпјҢдёӢеҲ—иҜҙжі•жӯЈзЎ®зҡ„жҳҜпјҲгҖҖгҖҖпјү
A . в‘ гҖҒв‘ЎгҖҒв‘ўдёӯдҫқж¬ЎзӣӣиЈ…KMnO4жә¶ж¶ІгҖҒжө“H2SO4гҖҒз„ҰжҖ§жІЎйЈҹеӯҗй…ёжә¶ж¶І
B . з®ЎејҸзӮүеҠ зғӯеүҚпјҢз”ЁиҜ•з®ЎеңЁв‘ЈеӨ„收йӣҶж°”дҪ“并зӮ№зҮғпјҢйҖҡиҝҮеЈ°йҹіеҲӨж–ӯж°”дҪ“жө“еәҰ
C . з»“жқҹеҸҚеә”ж—¶пјҢе…Ҳе…ій—ӯжҙ»еЎһKпјҢеҶҚеҒңжӯўеҠ зғӯ
D . иЈ…зҪ®QпјҲеҗҜжҷ®еҸ‘з”ҹеҷЁпјүд№ҹеҸҜз”ЁдәҺдәҢж°§еҢ–й”°дёҺжө“зӣҗй…ёеҸҚеә”еҲ¶еӨҮж°Ҝж°”
|
|
| 5. еҚ•йҖүйўҳ | |
|
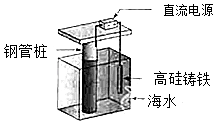
ж”Ҝж’‘жө·жёҜз ҒеӨҙеҹәзЎҖзҡ„й’ўз®ЎжҹұпјҢеёёз”ЁеӨ–еҠ з”өжөҒзҡ„йҳҙжһҒдҝқжҠӨжі•иҝӣиЎҢйҳІи…җпјҢе·ҘдҪңеҺҹзҗҶеҰӮеӣҫжүҖзӨәпјҢе…¶дёӯй«ҳзЎ…й“ёй“Ғдёәжғ°жҖ§иҫ…еҠ©йҳіжһҒпјҺдёӢеҲ—жңүе…іиЎЁиҝ°дёҚжӯЈзЎ®зҡ„жҳҜпјҲгҖҖгҖҖпјү
A . йҖҡе…ҘдҝқжҠӨз”өжөҒдҪҝй’ўз®ЎжЎ©иЎЁйқўи…җиҡҖз”өжөҒжҺҘиҝ‘дәҺйӣ¶
B . йҖҡз”өеҗҺеӨ–з”өи·Ҝз”өеӯҗиў«ејәеҲ¶д»Һй«ҳзЎ…й“ёй“ҒжөҒеҗ‘й’ўз®ЎжЎ©
C . й«ҳзЎ…й“ёй“Ғзҡ„дҪңз”ЁжҳҜдҪңдёәжҚҹиҖ—йҳіжһҒжқҗж–ҷе’Ңдј йҖ’з”өжөҒ
D . йҖҡе…Ҙзҡ„дҝқжҠӨз”өжөҒеә”иҜҘж №жҚ®зҺҜеўғжқЎд»¶еҸҳеҢ–иҝӣиЎҢи°ғж•ҙ
|
|
| 6. еҚ•йҖүйўҳ | |
|
зҹӯе‘Ёжңҹдё»ж—Ҹе…ғзҙ WгҖҒXгҖҒYгҖҒZзҡ„еҺҹеӯҗеәҸж•°дҫқж¬ЎеўһеӨ§пјҢWзҡ„з®ҖеҚ•ж°ўеҢ–зү©еҸҜз”ЁдҪңеҲ¶еҶ·еүӮпјҢYзҡ„еҺҹеӯҗеҚҠеҫ„жҳҜжүҖжңүзҹӯе‘Ёжңҹдё»ж—Ҹе…ғзҙ дёӯжңҖеӨ§зҡ„пјҺз”ұXгҖҒYе’ҢZдёүз§Қе…ғзҙ еҪўжҲҗзҡ„дёҖз§Қзӣҗжә¶дәҺж°ҙеҗҺпјҢеҠ е…ҘзЁҖзӣҗй…ёпјҢжңүй»„иүІжІүж·ҖжһҗеҮәпјҢеҗҢж—¶жңүеҲәжҝҖжҖ§ж°”дҪ“дә§з”ҹпјҺдёӢеҲ—иҜҙжі•дёҚжӯЈзЎ®зҡ„жҳҜпјҲгҖҖгҖҖпјү
A . Xзҡ„з®ҖеҚ•ж°ўеҢ–зү©зҡ„зғӯзЁіе®ҡжҖ§жҜ”Wејә
B . Yзҡ„з®ҖеҚ•зҰ»еӯҗдёҺXзҡ„е…·жңүзӣёеҗҢзҡ„з”өеӯҗеұӮз»“жһ„
C . YдёҺZеҪўжҲҗзҡ„еҢ–еҗҲзү©зҡ„ж°ҙжә¶ж¶ІеҸҜдҪҝи“қиүІзҹіи•ҠиҜ•зәёеҸҳзәў
D . ZдёҺXеұһдәҺеҗҢдёҖдё»ж—ҸпјҢдёҺYеұһдәҺеҗҢдёҖе‘Ёжңҹ
|
|
| 7. еҚ•йҖүйўҳ | |
|
еёёжё©дёӢе°ҶNaOHжә¶ж¶Іж·»еҠ еҲ°е·ұдәҢй…ёпјҲH2Xпјүжә¶ж¶ІдёӯпјҢж··еҗҲжә¶ж¶Ізҡ„pHдёҺзҰ»еӯҗжө“еәҰеҸҳеҢ–зҡ„е…ізі»еҰӮеӣҫжүҖзӨәпјҺдёӢеҲ—еҸҷиҝ°й”ҷиҜҜзҡ„жҳҜпјҲгҖҖгҖҖпјү
A . Ka2пјҲH2Xпјүзҡ„ж•°йҮҸзә§дёә10п№Ј6
B . жӣІзәҝNиЎЁзӨәpHдёҺlg
 зҡ„еҸҳеҢ–е…ізі»
C . NaHXжә¶ж¶ІдёӯcпјҲH+пјүпјһcпјҲOHп№Јпјү
D . еҪ“ж··еҗҲжә¶ж¶Іе‘ҲдёӯжҖ§ж—¶пјҢcпјҲNa+пјүпјһcпјҲHXп№ЈпјүпјһcпјҲX2п№ЈпјүпјһcпјҲOHп№Јпјү=cпјҲH+пјү зҡ„еҸҳеҢ–е…ізі»
C . NaHXжә¶ж¶ІдёӯcпјҲH+пјүпјһcпјҲOHп№Јпјү
D . еҪ“ж··еҗҲжә¶ж¶Іе‘ҲдёӯжҖ§ж—¶пјҢcпјҲNa+пјүпјһcпјҲHXп№ЈпјүпјһcпјҲX2п№ЈпјүпјһcпјҲOHп№Јпјү=cпјҲH+пјү
|
|
| 8. з»јеҗҲйўҳ | |
|
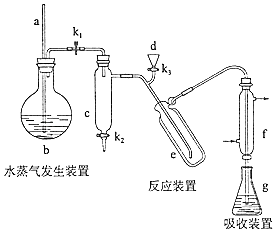
пјҲ15еҲҶпјүеҮҜж°Ҹе®ҡж°Ёжі•жҳҜжөӢе®ҡиӣӢзҷҪиҙЁдёӯж°®еҗ«йҮҸзҡ„з»Ҹе…ёж–№жі•пјҢе…¶еҺҹзҗҶжҳҜз”Ёжө“зЎ«й…ёеңЁеӮ¬еҢ–еүӮеӯҳеңЁдёӢе°Ҷж ·е“Ғдёӯжңүжңәж°®иҪ¬еҢ–жҲҗй“өзӣҗпјҢеҲ©з”ЁеҰӮеӣҫжүҖзӨәиЈ…зҪ®еӨ„зҗҶй“өзӣҗпјҢ然еҗҺйҖҡиҝҮж»ҙе®ҡжөӢйҮҸпјҺе·ІзҹҘпјҡNH3+H3BO3=NH3вҖўH3BO3пјӣNH3вҖўH3BO3+HCl=NH4Cl+H3BO3 пјҺ
еӣһзӯ”дёӢеҲ—й—®йўҳпјҡ
|
|
| 9. з»јеҗҲйўҳ | |||||||||||||
|
пјҲ14еҲҶпјүLi4Ti3O12е’ҢLiFePO4йғҪжҳҜй”ӮзҰ»еӯҗз”өжұ зҡ„з”өжһҒжқҗж–ҷпјҢеҸҜеҲ©з”Ёй’ӣй“ҒзҹҝпјҲдё»иҰҒжҲҗеҲҶдёәFe TiO3 пјҢ иҝҳеҗ«жңүе°‘йҮҸMgOгҖҒSiO2зӯүжқӮиҙЁпјүжқҘеҲ¶еӨҮпјҢе·ҘиүәжөҒзЁӢеҰӮдёӢпјҡ
еӣһзӯ”дёӢеҲ—й—®йўҳпјҡ
|
|||||||||||||
| 10. з»јеҗҲйўҳ | |
|
пјҲ14еҲҶпјүиҝ‘жңҹеҸ‘зҺ°пјҢH2SжҳҜ继NOгҖҒCOд№ӢеҗҺ第дёүдёӘз”ҹе‘ҪдҪ“зі»ж°”дҪ“дҝЎеҸ·еҲҶеӯҗпјҢе®ғе…·жңүеҸӮдёҺи°ғи§ЈзҘһз»ҸдҝЎеҸ·дј йҖ’гҖҒиҲ’еј иЎҖз®ЎеҮҸиҪ»й«ҳиЎҖеҺӢзҡ„еҠҹиғҪпјҺеӣһзӯ”дёӢеҲ—й—®йўҳпјҡ
|
|
- 2016е№ҙжұҹиҘҝзңҒиҗҚд№ЎеёӮдёҠж —еҺҝй«ҳиҖғеҢ–еӯҰдёҖжЁЎиҜ•еҚ·
- 2015-2016еӯҰе№ҙжІіеҚ—зңҒе‘ЁеҸЈеёӮдёӯиӢұж–ҮеӯҰж Ўй«ҳдәҢдёӢеӯҰжңҹжңҹдёӯеҢ–еӯҰиҜ•еҚ·
- йҷ•иҘҝзңҒжҰҶжһ—еёӮ2017-2018еӯҰе№ҙй«ҳиҖғзҗҶз»ј-еҢ–еӯҰдёүжЁЎиҖғиҜ•иҜ•еҚ·
- дё“йўҳ15пјҡе…ғзҙ е‘ЁжңҹиЎЁгҖҒе‘ЁжңҹеҫӢ
- 2016-2017еӯҰе№ҙзҰҸе»әзңҒзҰҸе·һеёӮе…«еҺҝдёҖдёӯиҒ”иҖғй«ҳдёҖдёҠеӯҰжңҹжңҹдёӯеҢ–еӯҰиҜ•еҚ·
- дё“йўҳ09пјҡеҚӨж—Ҹе…ғзҙ еҸҠе…¶еҢ–еҗҲзү©
- е№ҝдёңзңҒжғ е·һеёӮ2019-2020еӯҰе№ҙй«ҳдёүдёҠеӯҰжңҹзҗҶз»ј-еҢ–еӯҰ第дёҖж¬ЎжңҲиҖғиҜ•еҚ·
- й»‘йҫҷжұҹзңҒзүЎдё№жұҹеёӮдёңйғЁең°еҢәеӣӣж ЎиҒ”иҖғ2019-2020еӯҰе№ҙй«ҳдәҢдёҠеӯҰжңҹеҢ–еӯҰжңҹжң«иҖғиҜ•иҜ•еҚ·
- жұҹиӢҸзңҒеҫҗе·һеёӮ2017-2018еӯҰе№ҙй«ҳиҖғзҗҶз»ј-еҢ–еӯҰжЁЎжӢҹиҖғиҜ•иҜ•еҚ·
- жІіеҚ—зңҒйғ‘е·һеёӮ2017-2018еӯҰе№ҙй«ҳиҖғзҗҶз»ј-еҢ–еӯҰдёүжЁЎиҖғиҜ•иҜ•еҚ·
- еӨҮиҖғ2020е№ҙй«ҳиҖғеҢ–еӯҰдәҢиҪ®дё“йўҳ 14 еёёи§Ғжңүжңәзү©
- еҗүжһ—зңҒй•ҝжҳҘеёӮ第дәҢеҚҒдёӯеӯҰ2019-2020еӯҰе№ҙй«ҳдёҖдёӢеӯҰжңҹеҢ–еӯҰжңҹжң«иҖғиҜ•иҜ•еҚ·