广东肇庆市2020年高考理综-化学三模试卷
教材版本:化学
试卷分类:化学高考
试卷大小:1.0 MB
文件类型:.doc 或 .pdf 或 .zip
发布时间:2024-05-01
授权方式:免费下载
下载地址:点此下载
以下为试卷部分试题预览
| 1. 单选题 | |
|
“中国名片”“中国制造”中航天、军事、天文、医学等领域的发展受到世界瞩目,它们与化学有着密切的联系。下列说法正确的是( )
A . 港珠澳大桥路面使用到的沥青可以通过石油分馏得到
B . “玉兔二号”月球车的帆板太阳能电池的材料是二氧化硅
C . “歼-20”飞机上大量使用的碳纤维是一种新型有机高分子材料
D . 抗击“2019新型冠状病毒”过程中用到的“84”消毒液的主要有效成分是Ca(ClO)2
|
|
| 2. 单选题 | |
|
下列有关苯 (
A . 二者互为同分异构体
B . 二者可用酸性KMnO4溶液鉴别
C . (3)-轴烯与足量H2反应所得产物的二氯代物有5种
D . 苯分子中所有原子共平面,(3)-轴烯分子中所有原子不可能共平面
|
|
| 3. 单选题 | |
|
海水是十分重要的自然资源.如图是海水资源利用的部分过程,下列有关说法不正确的是( )

A . 第①步除去粗盐中的 Ca2+、Mg2+、SO42-等杂质离子加入试剂顺序为:NaOH 溶液→BaCl2溶液→Na2CO3溶液→过滤后加盐酸
B . 第②步由MgCl2•6H2O在空气中受热分解来制取无水MgCl2
C . 第③步可通入Cl2 , 第④⑤步的目的是富集溴元素
D . 海水淡化的方法主要有蒸馏法、电渗析法和离交换法
|
|
| 4. 单选题 | |||||||||||||||||||||
|
下列实验及现象不能得出相应结论的是( )
A . A
B . B
C . C
D . D
|
|||||||||||||||||||||
| 5. 单选题 | |
|
W、X、Y、Z 均为短周期主族元素,X与Z同族,X核外电子总数等于Y最外层电子数,Y是短周期中非金属性最强的元素,W与Z的最高化合价之和为8, 且W原子半径小于Z。下列叙述正确的是( )
A . 气态简单氢化物的稳定性:Z>X>W
B . W和Y可形成共价化合物WY3 , 且WY3中W、Y均满足最外层 8 电子稳定结构
C . 常温下,0.1 mol•L-1Z的最高价氧化物对应水合物水溶液的 pH >1
D . 常温下,与W同族且相邻元素的单质能溶于X的最高价氧化物对应水化物的浓溶液。
|
|
| 6. 单选题 | |
|
某新型可充电电池构造如图所示,工作时(需先引发Fe 和KClO3的反应,从而使 LiCl-KCl共晶盐熔化),某电极(记为X )的反应式之一为:xLi++ xe- +LiV3O8=Lii+xV3O8。下列说法正确的是( )
A . 放电时,正极的电极反应式为: Li – e- = Li+
B . 放电时,总反应式为:xLi + LiV3O8 = Lii+xV3O8
C . 充电时,X电极与外接电源负极相连
D . 充电时,X电极的质量增加
|
|
| 7. 单选题 | |
|
室温下,向10 mL 0.10mol•L1-1YOH溶液中逐渐滴加0.20mol•L-1HX 溶液,混合溶液的pH 变化如图所示(温度和体积变化忽硌不计)。下列结论不正确的是( )
A . HX为一元弱酸,YOH 为一元强碱
B . M点对应溶液中水的电离程度大于N 点溶液中水的电离程度
C . N点对应溶液中粒子浓度:c(HX)> c(X - ) > c(Y+ ) > c(H+ ) > c(OH-)
D . 室温时,pH = a 的YX溶液中水电离出的c(OH-)=l.0×10-(14-a)mol•L-1
|
|
| 8. 综合题 | |
|
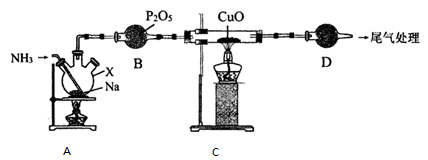
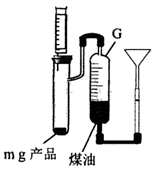
氨基钠(NaNH2)常用作有机合成的促进剂,是合成维生素 A 的原料。某学习小组用如下装置,以NH3和Na为原料加热至 350-360 ℃制备氨基钠,并检验其生成的产物和测定产品的纯度。
已知:NaNH2极易水解且易被空气氧化。回答下列问题 :
|
|
| 9. 综合题 | |
|
ZrO2常用陶瓷材料,可由锆英砂(主要成分为ZrSiO4, 也可表示为ZrO2•SiO2还含少量FeCO3、Fe2O3、Al2O3、SiO2等杂质)通过如下方法制取:
已知:①ZrSiO4能与烧碱反应生成可溶于水的Na2ZrO3 , Na2ZrO3与酸反应生成ZrO2+; ②常温下,Ksp[Fe(OH)3= 1×10-38 , Ksp [(Al(OH)3= 1×10-32;pH=6.2时,ZrO2+开始沉淀.
|
|
| 10. 综合题 | |
|
SO2的含量是衡量大气污染的一个重要指标。工业上常采用催化还原法、吸收法或电解法处理SO2。利用催化还原 SO2法 不仅可消除SO2污染,而且可得到有经济价值的单质S。
|
|
- 2016-2017学年安徽省宿州市埇桥区朱仙庄矿中学高一上学期期中化学试卷
- 2016年江西省萍乡市上栗县高考化学一模试卷
- 2015-2016学年河南省周口市中英文学校高二下学期期中化学试卷
- 陕西省榆林市2017-2018学年高考理综-化学三模考试试卷
- 专题15:元素周期表、周期律
- 2016-2017学年福建省福州市八县一中联考高一上学期期中化学试卷
- 专题09:卤族元素及其化合物
- 广东省惠州市2019-2020学年高三上学期理综-化学第一次月考试卷
- 黑龙江省牡丹江市东部地区四校联考2019-2020学年高二上学期化学期末考试试卷
- 江苏省徐州市2017-2018学年高考理综-化学模拟考试试卷
- 河南省郑州市2017-2018学年高考理综-化学三模考试试卷
- 备考2020年高考化学二轮专题 14 常见有机物




 S2(g)+2CO2(g)△H < 0。
S2(g)+2CO2(g)△H < 0。 



