高中化学人教版(2019)选择性必修1 第一章测试卷
高中化学人教版(2019)选择性必修1 第一章测试卷
教材版本:化学
试卷分类:化学高二上学期
试卷大小:1.0 MB
文件类型:.doc 或 .pdf 或 .zip
发布时间:2024-05-01
授权方式:免费下载
下载地址:点此下载
教材版本:化学
试卷分类:化学高二上学期
试卷大小:1.0 MB
文件类型:.doc 或 .pdf 或 .zip
发布时间:2024-05-01
授权方式:免费下载
下载地址:点此下载
以下为试卷部分试题预览
| 1. 单选题 | |
|
下列说法或表示方法中正确的是( )
A . 相同条件下,等质量的硫蒸气和硫固体分别完全燃烧,反应的热效应△H1>△H2
B . 由C(石墨)→C(金刚石)△H=+1.9kJ/mol,可知金刚石比石墨稳定
C . 已知在101KPa时,2gH2完全燃烧生成液态水,放出285.8kJ热量.则有关氢气燃烧热的热化学方程式为:2H2(g)+O2(g)═2H2O(l)△H=+285.8kJ/mol
D . 在稀溶液中,H+(aq)+OH﹣(aq)═H2O(l)△H=﹣57.3 kJ/mol,若将含0.5 mol硫酸的浓硫酸与含1 molNaOH的溶液混合,放出的热量大于57.3 kJ
|
|
| 2. 单选题 | |
|
下列说法不正确的是( )
A . 对于吸热反应,反应物所具有的总能量低于生成物所具有的总能量
B . 任何放热反应在常温条件一定能发生反应
C . 原电池反应一定是氧化还原反应
D . 元素由化合态变成游离态时,它可能被氧化,也可能被还原
|
|
| 3. 单选题 | |
|
乙醇的燃烧热为ΔH1 , 甲醇的燃烧热为ΔH2 , 且ΔH1<ΔH2 , 若乙醇和甲醇的混合物1 mol完全燃烧,反应热为ΔH3 , 则乙醇和甲醇的物质的量之比为( )
A .
 B .
B .  C .
C .  D .
D . 
|
|
| 4. 单选题 | |
|
已知:H2(g)+1/2O2(g)=H2O(g) ΔH1=-241.8 kJ·mol-1 , C(s)+1/2O2(g)=CO(g) ΔH2=-110.5 kJ·mol-1。由此可知焦炭与水蒸气反应的热化学方程式为:C(s)+H2O(g)=CO(g)+H2(g) ΔH3 , 则ΔH3为( )
A . +131.3 kJ·mol-1
B . -131.3 kJ·mol-1
C . +352.3 kJ·mol-1
D . -352.3 kJ·mol-1
|
|
| 5. 实验探究题 | ||||||||||||||||||||||||||||||||||||||||||||||||||||
|
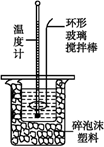
某实验小组用0.50 mol·L-1
NaOH溶液和0.50 mol·L-1硫酸进行中和热的测定。
|
||||||||||||||||||||||||||||||||||||||||||||||||||||
| 6. 单选题 | |
|
N2H4是一种高效清洁的火箭燃料。0.25 mol N2H4(g)完全燃烧生成氮气和气态水时,放出133.5 kJ热量。则下列热化学方程式中正确的是( )
A . 1/2N2H4(g)+1/2O2(g)=1/2N2(g)+H2O(g) ΔH=+267 kJ·mol-1
B . N2H4(g)+O2(g)=N2(g)+2H2O(g) ΔH=-534 kJ·mol-1
C . N2H4(g)+O2(g)=N2(g)+2H2O(g) ΔH=+534 kJ·mol-1
D . N2H4(g)+O2(g)=N2(g)+2H2O(l) ΔH=-133.5 kJ·mol-1
|
|
| 7. 单选题 | |
|
通过以下反应可获得新型能源二甲醚(
 )。下列说法错误的是( ) )。下列说法错误的是( ) ① ② ③ ④
A . 反应①、②为反应③提供原料气
B . 反应③也是
 资源化利用的方法之一
C . 反应 资源化利用的方法之一
C . 反应  的 的  D . 反应
D . 反应  的 的 
|
|
| 8. 综合题 | |||||||||||||||||||||||||
|
某化学小组用50ml 0. 50mol/L NaOH溶液和30ml 0.50mol/L硫酸溶液进行中和热的测定实验。
|
|||||||||||||||||||||||||
| 9. 单选题 | |
|
已知:(1)Zn(s)+1/2O2(g)=ZnO(s)ΔH=﹣348.3 kJ·
 2Ag(s)+1/2O2(g)=Ag2O(s)ΔH=﹣31.0 kJ· 2Ag(s)+1/2O2(g)=Ag2O(s)ΔH=﹣31.0 kJ· 
则Zn(s)+Ag2O(s)=ZnO(s)+2Ag(s)的ΔH等于( )
A . ﹣317.3 kJ·
 B . ﹣379.3 kJ·
B . ﹣379.3 kJ·  C . ﹣332.8 kJ·
C . ﹣332.8 kJ·  D . +317.3 kJ·
D . +317.3 kJ· 
|
|
| 10. 综合题 | |
|
在化学反应中,只有极少数能量比平均能量高得多的反应物分子发生碰撞时才可能发生化学反应,这些分子被称为活化分子。使普通分子变成活化分子所需提供的最低限度的能量叫活化能,其单位通常用kJ·mol-1表示。请认真观察下图,然后回答问题。
|
|
高中化学 试卷推荐
- 高中化学人教版(2019)必修第一册 第四章第二节 元素周期律
- 浙江省宁波市2019-2020学年高一下学期化学期末考试试卷
- 2015-2016学年江苏省宿迁市高一上学期期末化学试卷
- 湖北省重点高中联考2016-2017学年高二上学期化学期中考试试卷
- 安徽省合肥市2018-2019学年高考化学三模考试试卷
- 2016年河北省沧州市高考化学模拟试卷(4月份)
- 人教版化学选修一第一章第一节生命的基础能源——糖类同步练习
- 江苏省扬州市2020年高考化学6月试卷
- 2015-2016学年湖南省衡阳市衡阳县四中高二下学期期中化学试卷
- 2017年山西省吕梁市孝义市高考化学考前热身试卷 ,
- 吉林省吉林市蛟河市第一中学2019-2020学年高二上学期化学期中考试试卷
- 人教版化学高二选修5第二章第一节脂肪烃同步练习
最近更新