高中化学人教版(2019)选择性必修1 第三章第一节 电离平衡
教材版本:化学
试卷分类:化学高二上学期
试卷大小:1.0 MB
文件类型:.doc 或 .pdf 或 .zip
发布时间:2024-05-01
授权方式:免费下载
下载地址:点此下载
以下为试卷部分试题预览
| 1. 综合题 | |||||||||||
|
下表是几种常见弱酸的电离常数(25 ℃)。
回答下列问题:
|
|||||||||||
| 2. 综合题 | |
|
已知:25 ℃时,CH3COOH和NH3·H2O的电离常数相等。
|
|
| 3. 单选题 | |
|
H2S水溶液中存在电离平衡:H2S
 H++HS-和HS- H++HS-和HS-  H++S2- , 若向H2S溶液中( ) H++S2- , 若向H2S溶液中( )
A . 加入硫酸,平衡向右移动,溶液中氢离子浓度增大
B . 通入过量SO2气体,溶液酸性减弱
C . 通入氯气,平衡向左移动,溶液酸性增强
D . 加入少量硫酸铜固体(忽略体积变化),溶液中所有离子浓度都减小
|
|
| 4. 综合题 | |
|
现有下列六种物质:①Al②熔融KHSO4 ③Ba(OH)2固体④CO2 ⑤盐酸⑥Fe(OH)3胶体,请回答下列问题。
|
|
| 5. 综合题 | |||||||||||||||
|
“绿水青山就是金山银山”,近年来,绿色发展、生态保护成为中国展示给世界的一张新“名片”。汽车尾气是造成大气污染的重要原因之一,减少氮的氧化物在大气中的排放是环境保护的重要内容之一。请回答下列问题:
|
|||||||||||||||
| 6. 单选题 | |
|
常温下,向20mL 0.05mol·L-1的某稀酸H2B溶液中滴入0.1mol·L-1氨水,溶液中由水电离出氢离子浓度随滴入氨水体积变化如图。下列分析正确的是( )
A . NaHB溶液可能为酸性,也可能为碱性
B . A,B,C三点溶液的pH是逐渐减小,D,E,F三点溶液的pH是逐渐增大
C . B点溶液c(NH4+)=2c(B2-)
D . E溶液中离子浓度大小关系:c(NH4 +)> c(B2-)> c(H+)>c(OH-)
|
|
| 7. 单选题 | |
|
某温度下,HF和CH3COOH的电离常数分别为3.5×10-4和1.7×10-5。将pH和体积均相同的NaF和CH3COONa溶液分别稀释,其pH随加水体积的变化如图所示。下列叙述正确的是( )
A . 曲线I代表CH3COONa溶液
B . 溶液中水的电离程度:c点>b点
C . 从b点到d点,溶液中
 保持不变(其中HA,A-分别代表相应的酸和酸根离子)
D . 相同体积a点的两溶液分别与HCl恰好反应后,溶液中 保持不变(其中HA,A-分别代表相应的酸和酸根离子)
D . 相同体积a点的两溶液分别与HCl恰好反应后,溶液中  相同 相同
|
|
| 8. 单选题 | |
|
溶液的pH、体积相同的盐酸和醋酸两种溶液,下列叙述错误的是( )
A . 它们与NaOH完全中和时,醋酸溶液所消耗的NaOH多
B . 它们分别与足量CaCO3反应时,放出的CO2一样多
C . 两种溶液中n(Cl-)=n(CH3COO-)
D . 分别用水稀释相同倍数时,n(Cl-)<n(CH3COO-)
|
|
| 9. 单选题 | |
|
下列物质依次按照混合物、氧化物、弱电解质和非电解质的顺序排列的一组是( )
A . 淀粉、CuO、HClO、Cu
B . 水玻璃、Na2O·CaO·6SiO2、Ag2O、SO3
C . 普通玻璃、H2O、CH3COOH、葡萄糖
D . KAl(SO4)2·12H2O、KClO3、H2O、CH3CH2OH
|
|
| 10. 单选题 | |
|
为了证明一水合氨(NH3•H2O)是弱电解质,常温下做以下实验没有意义的是( )
A . 用pH试纸测得0.010 mol/L氨水的pH为10
B . 用pH试纸测得0.10mol/L NH4Cl溶液的pH<7
C . 比较浓度均为 0.1 mol·L-1NaOH溶液和氨水的导电能力
D . 取10mL 0.010mol/L氨水,滴入2滴酚酞,显粉红色,再滴加少量稀盐酸,颜色变浅
|
|
- 2017年江苏省高考化学试卷 (正式版)
- 四川省绵阳市2017-2018学年高三理综-化学二模考试试卷
- 2017-2018学年高中化学新人教版必修二第二章化学反应与能量2.1化学能与热能
- 四川省泸州市2019-2020学年高一下学期化学期末考试试卷
- 安徽省芜湖市示范高中2020年高考理综-化学5月模拟试卷
- 2017_2018学年高中化学人教版选修四 第四章电化学基础4.4金属的电化学腐蚀与防护
- 浙江省杭州市塘栖中学2019-2020学年高一下学期化学3月月考试卷
- 江苏省南通市通州区2019-2020学年高一下学期化学期末考试试卷
- 福建省南平市2018-2019学年高三上学期化学期末考试试卷
- 高中化学人教版 必修1 第二章 化学物质及其变化 2.离子反应 离子反应及其发生的条件
- 2015-2016学年江苏省无锡市江阴市四校联考高一下学期期中化学试卷
- 人教(新课标)高中化学一轮复习:专题10化学反应速率与化学平衡

 ,则此反应的热化学方程式为。
,则此反应的热化学方程式为。 4NO2(g)+O2(g),某温度下向恒容密闭容器中加入一定量N2O5 , 测得N2O5浓度随时间的变化如下表:
4NO2(g)+O2(g),某温度下向恒容密闭容器中加入一定量N2O5 , 测得N2O5浓度随时间的变化如下表:
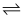 NO(g)+CO2(g),该反应中正反应速率v正=k正·p(NO2)·p(CO),逆反应速率v逆=k逆·p(NO)·p(CO2),其中k正、k逆为速率常数,则Kp为(用k正、k逆表示)。
NO(g)+CO2(g),该反应中正反应速率v正=k正·p(NO2)·p(CO),逆反应速率v逆=k逆·p(NO)·p(CO2),其中k正、k逆为速率常数,则Kp为(用k正、k逆表示)。







