黑龙江省大庆市2021年高考化学二模试卷
教材版本:化学
试卷分类:化学高考
试卷大小:1.0 MB
文件类型:.doc 或 .pdf 或 .zip
发布时间:2024-05-01
授权方式:免费下载
下载地址:点此下载
以下为试卷部分试题预览
| 1. 单选题 | |
|
国家“十四五战略规划”中提出全面推进绿色发展,生态环境保护、资源可持续利用均与化学密切相关。下列有关说法错误的是( )
A . “地沟油”经过加工处理可用来制肥皂,实现了厨余垃圾的合理利用
B . 废旧电池深度填埋处理容易造成土壤重金属污染
C . 臭氧/生物活性炭技术可用于饮用水的深度处理,利用了活性炭的还原性
D . 乙醇可通过淀粉等生物原料发酵制得,属于可再生资源
|
|
| 2. 单选题 | |
|
设NA为阿伏加德罗常数的值。下列说法错误的是( )
A . 7.8 g Na2O2晶体中阳离子和阴离子总数为0.3NA
B . 标准状况下,11.2 L 3He含有NA个中子
C . 100 mL 0.1 mol·L-1的Al2(SO4)3溶液,溶液中的Al3+数目小于0.02NA
D . 电解精炼铜时,若阳极质量减少64 g,则转移电子的数目不一定等于2NA
|
|
| 3. 单选题 | |
|
绿原酸可从中药材杜仲和金银花、果蔬土豆和苹果中提取得到,具有抗病毒、降血压、降血脂等药效,其结构简式如图所示。有关该化合物,下列叙述错误的是( )
A . 分子式为C16H18O9
B . 分子中所有碳原子不可能共平面
C . 能发生水解反应
D . 能使酸性高锰酸钾溶液、溴水褪色,且褪色原理相同
|
|
| 4. 单选题 | ||||||||||||||||
|
室温下进行下列实验,根据实验操作、现象和所得到的实验结论均正确的是( )
A . A
B . B
C . C
D . D
|
||||||||||||||||
| 5. 单选题 | |
|
短周期主族元素X、Y、Z、W的原子序数依次增大,Z的最外层电子数是电子层数的3倍,W和Z同主族。甲、乙、丙是上述元素的单质,丁、戊、己是由这些元素组成的二元化合物,其中由X、Y组成的化合物丁的水溶液显碱性。上述物质的转化关系如图所示。下列说法正确的是( )
A . 原子半径大小为W>Z>Y>X
B . X和Z两种元素形成的化合物中可能含有非极性共价键
C . 二元化合物沸点大小为戊>己>丁
D . 四种元素组成的化合物一定能促进水的电离
|
|
| 6. 单选题 | |
|
一种新型电解废水处理技术是以活性炭为电极板和粒子凝胶颗粒填充的电解装置(如图所示)。该装置电解过程中产生的羟基自由基(·OH)氧化能力极强,能将苯酚(C6H6O)氧化为CO2和H2O。下列说法错误的是( )
A . b的电极反应为H2O-e-=·OH+H+
B . 电子迁移方向:直流电源负极→a电极,b电极→直流电源正极
C . 苯酚被氧化的化学方程式为C6H6O+28·OH=6CO2↑+17H2O
D . 当两极室产生气体体积为5.6 L时,电路中转移电子0.35 mol
|
|
| 7. 单选题 | |
|
25℃时,向0.1 mol·L-1的二元弱酸H2A溶液中滴加相同浓度的烧碱溶液,溶液中的H2A、HA-、A2-的物质的量分数δ(X)随pH的变化如图所示[已知:δ(X)=
 ],下列说法错误的是( ) ],下列说法错误的是( )
A . H2A的Ka1=1×10-1.2
B . NaHA溶液中,c(H+)>c(OH-)
C . pH由1.2到3的变化过程中,发生的反应只有H2A+OH-=HA-+H2O
D . pH=4.2的溶液中,c(Na+)+c(H+)=3c(A2-)+c(OH-)
|
|
| 8. 综合题 | |||||||||||
|
氯化亚铜(CuCl)可用作有机合成的催化剂,CuCl微溶于水,不溶于醇和稀酸,可溶于Cl-浓度较大的溶液(CuCl+Cl-
 CuCl CuCl  ),在潮湿空气中易水解、易氧化。工业上用黄铜矿(主要成分是CuFeS2 , 还含有少量的SiO2)制备CuCl的工艺流程如图: ),在潮湿空气中易水解、易氧化。工业上用黄铜矿(主要成分是CuFeS2 , 还含有少量的SiO2)制备CuCl的工艺流程如图: 25℃时,相关物质的Ksp见表。
回答下列问题:
|
|||||||||||
| 9. 实验探究题 | |
|
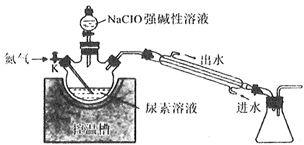
水合肼(N2H4·H2O)是一种重要的化工原料,工业上用尿素[CO(NH2)2]、NaOH和NaClO溶液反应制备水合肼的实验流程如图:据此某化学兴趣小组设计了下列实验制备N2H4·H2O。
查阅资料:①3NaClO
|
|
| 10. 综合题 | |
|
央广网消息:2020年大庆油田生产天然气46.6亿立方米,实现了“十连增”,在大战大考中交出了“当好标杆旗帜、建设百年油田”的新答卷。天然气的主要成分甲烷是一种重要的化工原料,广泛应用于民用和化工业生产中。回答下列问题:
|
|
- 吉林省长春市2022届高三质量监测线上考试(三)理综化学试题
- 四川省德阳市2022届高三三诊理综化学试题
- 浙江省宁波市2021-2022学年高三上学期化学10月月考试卷
- 广东省广州市海珠区2021-2022学年高一上学期期末考试化学试题
- 广西北海市2021-2022学年高三上学期第一次化学模拟考试理综化学试题
- 江西省九江市2021年高考化学二模试卷
- 湖北省腾云联盟2021-2022学年高三上学期化学10月联考试卷
- 江苏省连云港市东海县2021-2022学年高二下学期期中考试化学试题
- 2021高考真题汇编-化学反应中的能量变化
- 上海市虹口区2021年高考化学二模试卷
- 吉林省永吉县第四中学2021-2022学年高一上学期化学9月月考试卷
- 辽宁省大连市2022届高三第一次模拟考试化学试题

 、SO
、SO 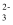 的溶液中逐滴滴加盐酸,立即产生气泡
的溶液中逐滴滴加盐酸,立即产生气泡




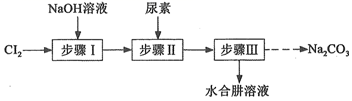
 2NaCl+NaClO3;②N2H4·H2O易溶于水,熔点-40℃,沸点为118℃,具有强还原性,能与NaClO剧烈反应生成N2;属于二元弱碱,在空气中可吸收CO2而产生烟雾。
2NaCl+NaClO3;②N2H4·H2O易溶于水,熔点-40℃,沸点为118℃,具有强还原性,能与NaClO剧烈反应生成N2;属于二元弱碱,在空气中可吸收CO2而产生烟雾。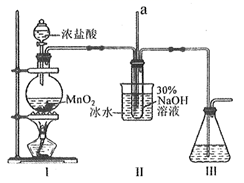

 ,T2℃下,上述反应0~2min内平均反应速率v(CH4)=kPa·min-1。(分压=总压×物质的量分数)
,T2℃下,上述反应0~2min内平均反应速率v(CH4)=kPa·min-1。(分压=总压×物质的量分数)




