四川省雅安市2021年高考化学三模试卷
教材版本:化学
试卷分类:化学高考
试卷大小:1.0 MB
文件类型:.doc 或 .pdf 或 .zip
发布时间:2024-05-01
授权方式:免费下载
下载地址:点此下载
以下为试卷部分试题预览
| 1. 单选题 | |
|
化学与生活息息相关,下列说法正确的是( )
A . 淀粉和纤维素都属于多糖
B . 天然药物无毒副作用,可以长期服用
C . SO2有毒,严禁将其添加到任何食品和饮料中
D . 废弃的聚乙烯塑料属于白色垃圾,能使溴水褪色
|
|
| 2. 单选题 | |
|
下列化合物的分子中,所有原子可能共平面的是( )
A . 环己烷
B . 乙醇
C . 丙烯
D . 苯乙烯
|
|
| 3. 单选题 | |
|
短周期主族元素X、Y、Z位于同一周期,它们的原子最外层电子数之和为11,Y的族序数等于其周期序数,Z的阳离子半径在同周期元素的阳离子中最大。下列说法正确的是( )
A . 化合物Z2O2是只含离子键的离子化合物
B . 工业上制备Y的单质可以电解熔融的YX3
C . 最高价氧化物对应水化物的碱性:Z>Y
D . 常温下,Y和Z的单质均能溶于浓硫酸
|
|
| 4. 单选题 | |
|
用NA表示阿伏加德罗常数,下列说法正确的是( )
A . 2.4g镁在空气中燃烧生成MgO和Mg3N2 , 转移电子数无法计算
B . 密闭容器中,2mol SO2和1mol O2催化反应后分子总数大于2NA
C . 1 mol羟基中含有的电子数为10NA
D . 标准状况下,22.4LHCl溶于水后溶液中有NA个HCl分子
|
|
| 5. 单选题 | |
|
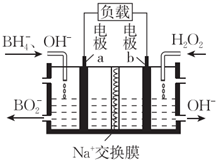
一种以NaBH4和H2O2为原料的新型电池的工作原理如图所示。下列说法错误的是( )
A . 电池的正极反应为H2O2+2e-=2OH-
B . 电池放电时,Na+移向b极区
C . 温度越高,该电池性能提高越大
D . 理论上两极分别产生的OH-和
 的物质的量之比为8:1 的物质的量之比为8:1
|
|
| 6. 单选题 | |||||||||||||||||||||
|
下列化学实验操作、现象和结论均正确的是( )
A . A
B . B
C . C
D . D
|
|||||||||||||||||||||
| 7. 单选题 | |
|
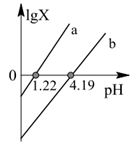
草酸(H2C2O4)是一种二元弱酸。常温下向草酸溶液中滴加NaOH溶液,混合溶液中lgX[x表示
 或 或  ]随pH的变化如图。下列说法中错误的是( ) ]随pH的变化如图。下列说法中错误的是( )
A . NaHC2O4溶液呈酸性
B . H2C2O4第二步电离常数数量级是10-5
C . pH=7时,c(Na+)=c(
 )+2c( )+2c(  )
D . 1.22<pH<4.19时,c( )
D . 1.22<pH<4.19时,c(  )>c( )>c(  )>c(H2C2O4) )>c(H2C2O4)
|
|
| 8. 实验探究题 | |
|
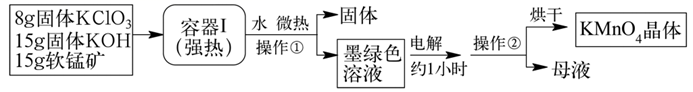
实验室熔融法合成高锰酸钾的反应原理:将软锰矿(主要成分为MnO2)、碱和KClO3(还原产物为KCl)混合强热共熔,即可得到墨绿色的锰酸钾熔体。然后再电解锰酸钾溶液得到高锰酸钾。
[实验I]:KMnO4合成步骤过程如下图所示: [实验II]:KMnO4纯度测定 称取自制的KMnO4晶体2.000g,配制成250.00mL溶液。取25.00mL0.1000mol/L草酸标准液溶液于锥形瓶中,加入25.00mL1mol/L硫酸,混合均匀后加热到75~85℃,用KMnO4溶液滴定,重复操作3次,平均消耗20.00mLKMnO4溶液。 请根据上述实验回答下列问题
|
|
| 9. 综合题 | ||||||||||||||||
|
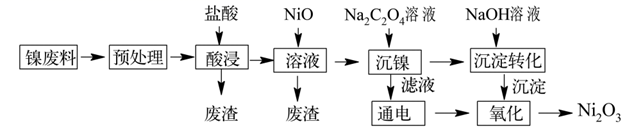
三氧化二镍(Ni2O3)是重要的电子元件材料和蓄电池材料,工业上利用含镍废料(主要成分为镍、铝、氧化铁、碳等)提取Ni2O3 , 工艺流程如下:
已知:①NiCl2易溶于水,Fe3+不能氧化Ni2+。 ②实际生产温度时的溶解度:NiC2O4>NiC2O4·H2O>NiC2O4·2H2O。 ③相关金属离子生成氢氧化物沉淀的pH如下(开始沉淀的pH按金属离子的浓度为1mol·L-1计算):
|
||||||||||||||||
| 10. 综合题 | ||||||||||||||||||||||||||||
|
在氮及其化合物的化工生产中,对有关反应的反应原理进行研究有着重要意义。
|
||||||||||||||||||||||||||||
- 甘肃省张掖市2018-2019学年高二上学期化学期末考试试卷
- 江苏省泰州市姜堰区2014-2015学年高三下学期化学开学考试试卷
- 2015-2016学年福建省莆田七中高一下学期期中化学试卷
- 2015-2016学年四川省广元市剑州中学高一上学期第一次月考化学试卷
- 2015-2016学年浙江省杭州市七校联考高一下学期期中化学试卷
- 广东省揭阳市2018-2019学年高二下学期化学期末考试试卷
- 2016-2017学年湖北省黄冈市蕲春县高二上学期期中化学试卷
- 广西桂梧高中2017-2018学年高一下学期化学第一次月考考试试卷
- 吉林省蛟河市友好学校2019-2020学年高一上学期化学期中考试试卷
- 广东省茂名市2017-2018学年高三理综-化学第二次模拟考试试卷
- 湖南省怀化市2019-2020学年高二下学期化学期末考试试卷
- 高中化学人教版(2019)必修第一册第二章第三节 物质的量

 ,k为速率常数。以下说法正确的是(填字母)
,k为速率常数。以下说法正确的是(填字母)


