第5节 物质的溶解 知识点题库
酒精具有杀菌消毒的作用,能使细菌的蛋白质脱水、凝固、变性,这种变化属于 变化,要配置100克溶质质量分数为75%的消毒酒精,溶解时要用 搅拌.
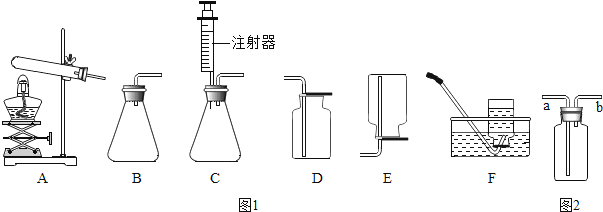
如图是实验室常用气体制备装置,据图回答问题:
-
(1) 实验室用高锰酸钾制氧气的化学方程式是 ,应选择的收集装置是 (填字母代号),如果选用如图2装置收集氧气,气体应从 (填“a”或“b”)端导入.
-
(2) 实验室用过氧化氢溶液和二氧化锰制取氧气的化学方程式为 .某化学小组同学用20%的过氧化氢溶液和二氧化锰,并选用B装置来制氧气.实验中,同学们发现不能得到平稳的氧气流.大家提出从两个方面加以改进:
一是把发生装置由B改为C,其理由是 ;
二是将过氧化氢溶液加水稀释,溶液的稀释须要经过计算,量取,搅匀三个步骤.
如果把50g质量分数为20%的过氧化氢溶液稀释成5%的过氧化氢溶液,需加水的质量为 g;在稀释过程中,除了烧杯外,还需要用到的仪器有 (填数字序号).
①量筒 ②药匙 ③试管 ④酒精灯 ⑤滴管 ⑥玻璃棒.
如图所示,瓶中X为固体,当把滴管内的液体Y滴入瓶中,导管口一定没有气泡产生的是( )

A | B | C | D | |
X | MnO2 | CaO | NaHCO3 | NH4NO3 |
Y | H2O2 | H2O | HCl | H2O |
A . A
B . B
C . C
D . D
20℃时,某物质溶解于水的实验数据如表.则下列叙述正确的是( )
实验序号 | 水的质量(g) | 加入该物质的质量(g) | 剩余未溶解固体的质量(g) |
① | 10 | 2 | 0 |
② | 10 | 3 | 0 |
③ | 10 | 4 | 0.4 |
④ | 10 | 5 | 1.4 |
A . 溶液质量由大到小的顺序为:④>③>②>①
B . 20℃时10g饱和溶液溶有3.6g该物质
C . 20℃时10g水最多洛解3.6g该物质
D . ①所得溶液的溶质质量分数为20%
小新用氢氧化钠溶液制作“叶脉书签”,已知实验室里有一种溶液,200g该溶液中含有8g氢氧化钠,计算:
-
(1) 氢氧化钠的质量分数为多少?(写出计算过程)
-
(2) 将200g滤液浓缩制成“叶脉书签”所需要质量分数为10%的氢氧化钠溶液,需蒸发水g.
欲配制25g质量分数为10%的氯化钠溶液,下列说法不正确的是( )
A . 实验中用到的玻璃仪器只有烧杯和量筒
B . 计算得氯化钠的质量为2.5g,水的体积为22.5mL
C . 量取水时,若俯视读数,会使配得的溶液浓度偏大
D . 用天平称取该固体时将砝码和物品放反,会导致配得的溶液浓度偏小
20℃时,四个实验小组分别取不同质量的NaCl,逐渐加入到各盛有50g水的烧杯中,不断搅拌直到不再溶解为止,然后分别称量剩余NaCl的质量。记录数据如下表:
实验小组 | 第一组 | 第二组 | 第三组 | 第四组 |
水的质量/g | 50 | 50 | 50 | 50 |
所取NaCl的质量/g | 15 | 20 | 25 | 30 |
剩余NaCl的质量/g | 0 | 2 | 7 | 12 |
下列说法错误的是( )
A . 20℃时,50gNaCl饱和溶液中含有18gNaCl
B . 用蒸发的方法可以使不饱和溶液变成饱和溶液
C . 第二组所得溶液的溶质与溶剂的质量比为9:25
D . 相同温度下,NaCl在水里的溶解度与水的质量无关
如图是恒温下蒸发溶剂过程的示意图,与丙烧杯内溶液的溶质质量分数一定相同的是( )

A . 甲
B . 甲和乙
C . 乙和丁
D . 丁
如表是氯化钠(NaCl)和硝酸钾(KNO3)在不同温度时的溶解度,回答问题。
温度/℃ | 10 | 20 | 30 | 40 | 50 | 60 |
溶解度/g | ||||||
NaCl | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 |
KNO3 | 20.9 | 31.6 | 45.8 | 63.9 | 85.5 | 110.0 |
-
(1) 两种物质中,溶解度受温度影响变化较大的是。
-
(2) 60 ℃时,按图示操作:

A中溶液是(填“饱和”或“不饱和”)溶液,C中溶液的总质量是克。
-
(3) 50 ℃时,将两种物质的饱和溶液各100克,分别加热蒸发10克水后,再恢复到50 ℃,剩余溶液的质量:NaCl溶液(填“大于”“等于”或“小于”)KNO3溶液。
向一定质量FeCl2和CuCl2的混合溶液中加入锌粉,反应过程中,混合物中溶液的质量与加入锌的质量关系如图所示。有关该反应过程中混合物中的溶液和固体,下列说法正确的是( )

A . a点时,溶液中只含有两种溶质
B . c点时,向固体中滴加稀盐酸,无气泡产生
C . d点时,溶液中的溶质为ZnCl2
D . e点时,固体中只含有2种物质
室温下,将氢氧化钠溶液慢慢滴入装有稀盐酸的烧杯中,利用温度计测出烧杯中溶液的温度,溶液温度随加入氢氧化钠溶液的质量而变化的曲线如图所示:

-
(1) 由图可知,盐酸与氢氧化钠反应是(填“吸热” 或“放热”或“无热量变化”)反应。从A到C的过程中溶液的pH逐渐(填“增大”或“减小”或“无变化”);
-
(2) C点溶液的溶质是(填化学式)。向C点溶液中滴加硫酸铁溶液,观察到的现象为,反应的化学方程式为。
向盛有50克硝酸钾的烧杯中加入50克水,充分溶解后现象如图所示,此时溶液温度为30℃。下列说法正确的是( )

A . 烧杯中的溶液总质量为100克,溶液的溶质质量分数为50%
B . 烧杯中的溶液为30℃时硝酸钾饱和溶液,且30℃时硝酸钾的溶解度为100克
C . 若使烧杯中的固体全部溶解,则溶液的溶质质量分数一定增大
D . 若使烧杯中的溶液变为不饱和溶液,则溶液的溶质质量分数可能增大
配制50g16%的氯化钠溶液,常按以下操作顺序进行。

-
(1) 用如图所示的序号表示正确配制该溶液的操作顺序为。
-
(2) 以上实验步骤,其中操作错误的有。
-
(3) 用托盘天平称量所需的氯化钠时,发现托盘天平的指针偏向左盘,应 。A . 增加适量氯化钠固体 B . 减少适量氯化钠固体 C . 调节游码 D . 添加砝码
-
(4) 将氯化钠和水依次倒入烧杯中,接下来玻璃棒的作用是为。
-
(5) 如果量取液体时俯视读数,会导致所得溶液溶质质量分数。(选填“变大”,“变小”或“不变”)
啤酒内均溶有一定量的二氧化碳气体,当打开瓶盖时你会发现啤酒自动喷出来,由此可以推测气体溶解度大小与有关;喝了啤酒后又常常会打嗝,由此可以推测气体溶解度大小会随着温度的升高而(此空填“增大、不变,或减小”)。
烧杯①中溶液是60℃时含有120g水的NH4Cl溶液,经过下图操作后得到18.0gNH4Cl固体,已知60℃和20℃时,NH4Cl的溶解度分别为55.2g和37.2g,下列说法正确的是( )
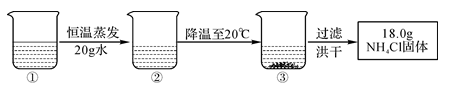
A . ②中溶液和③中溶液分别为60℃和20℃时NH4Cl的饱和溶液
B . ①中溶液和②中溶液均为60℃时NH4Cl的不饱和溶液
C . ①中溶液的溶质质量大于②中溶液的溶质质量
D . ②中溶液和③中溶液的溶质质量分数相等
如图所示为蒸发氯化钠溶液的过程,其中①→②→③为恒温蒸发过程,③→④为升温蒸发过程,②溶液恰好为饱和状态,分析实验过程,可以作出的正确判断是( )

A . 在①→②过程中,氯化钠的质量分数保持不变
B . 在②→③过程中,氯化钠的溶解度不断增大
C . 在③→④过程中,氯化钠的质量分数不断减小
D . 在②→④过程中,氯化钠的质量分数先不变后增大
欲配制100g10%的氯化钠(NaCl)溶液,操作如图所示.
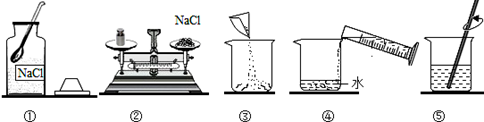
请回答下列问题:
-
(1) 按图中操作,会导致溶液的溶质质量分数 (选填“偏大”、“偏小”或“无影响”)。
-
(2) 20℃时,某同学将配置的 100g10%的氯化钠(NaCl)溶液,第一次恒温蒸发65g水,析出1g,再恒温蒸发5g水,又析出晶体1.8g, 该温度下氯化钠的溶解度是g。
-
(3) 实验室现有5%的氯化钠溶液、20%的氯化钠溶液、水、氯化钠固体,请选择其中两种试剂混合,配制10%的氯化钠溶液,所需试剂质量的最简整数比。
例如:选择水和氯化钠固体,质量比9:1混合。请再写出一种合理方案。
方案:。
放在普通环境里的鸡蛋容易变质。鲜鸡蛋密度约为1.08g/cm3 , 变质蛋密度可降至1.03g/cm3以下。生活中,我们可以把鸡蛋放入密度为1.03g/cm3的盐水中来判断鸡蛋是否变质。
-
(1) 如图所示甲、乙、丙三个鸡蛋静止在盐水中,其中最有可能已变质的是(填“甲”、“乙”或“丙”)鸡蛋。

-
(2) 配制密度1.03g/cm3的食盐水可用60g食盐溶于1000g水中,这种食盐水的质量分数约为%。(计算结果小数点后保留一位)。
-
(3) 实验室在配制以上食盐水溶液时,操作步骤如图,正确的操作顺序是(填序号)。玻璃棒在溶液的配置中的作用是。

将二氧化碳气体缓缓通入质量分数为20%的氢氧化钠溶液中,溶液中某元素质量分数.y随时间的变化趋势如图。则y坐标表示的是( )
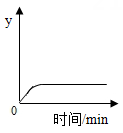
A . 钠元素的质量分数
B . 氧元素的质量分数
C . 氢元素的质量分数
D . 碳元素的质量分数
根据氯化钠和硝酸钾的溶解度表, 请回答下列问题:
|
温度(℃) |
10 |
20 |
30 |
40 |
50 |
60 |
70 |
|
氯化钠溶解度(克) |
35.8 |
36.0 |
36.3 |
36.4 |
37.0 |
37.3 |
37.8 |
|
硝酸钾溶解度(克) |
20.9 |
31.6 |
45.8 |
63.9 |
85.5 |
110 |
138 |
-
(1) 20℃时,氯化钠饱和溶液溶质的质量分数硝酸钾饱和溶液溶质的质量分数(填 “大于”、“等于”或“小于”)。
-
(2) 60℃时, 向 50 克水中加入 60 克硝酸钾, 求充分搅拌溶解后所得溶液溶质的质量分数。(结果精确到 0.1%)
最近更新



