第5节 物质的溶解 知识点题库
某品牌汽车使用一段时间后,日行灯的反光碗上面部分就开始发白,影响反光效果。

-
(1) 初步探究
【猜想】日行灯工作时的高温使反光碗表面物质熔化后变白。
【查阅资料】反光碗材料为表面镀铬的团状模塑料,它的耐热性比一般工程塑料好,热变形温度为200~280℃,可长期在130℃下使用。铬的熔点为1800℃。
【实验】该灯正常工作时,每20min测一次反光碗发白处附近的温度,发现温度逐渐升高,3h后保持在75℃左右。
上述实验中需用到的测量仪器有 。
【分析评价】上述获取的证据能否支持猜想并说明理由: 。
-
(2) 进一步探究
【观察】发现灯座的焊接点附近有松香残迹。
【查阅资料】松香外观为淡黄色至淡棕色(粉末为白色),有松节油气味,密度1.06~1.09/cm3 , 软化点72~76℃,沸点约300℃,加热后能挥发,不溶于水,能溶于酒精等有机溶剂。
【提出假设】反光碗上面部分发白是由于 产生的。
【制定方案】发白处用来清洗,使它溶解。
【实验】按制定方案清洗,表面的白色同体溶解,反光碗重新变得光亮。
 20℃时,向一定量的硝酸钾不饱和溶液中加入硝酸钾固体
B .
20℃时,向一定量的硝酸钾不饱和溶液中加入硝酸钾固体
B .  将等质量的镁片和铁片投入到足量稀硫酸中
C .
将等质量的镁片和铁片投入到足量稀硫酸中
C .  用酒精灯加热一定量的高锰酸钾固体
D .
用酒精灯加热一定量的高锰酸钾固体
D .  向盛有少量二氧化锰的烧杯中不断加入H2O2溶液
向盛有少量二氧化锰的烧杯中不断加入H2O2溶液
如图为物质W(不含结晶水)的溶解度曲线。M、N两点分别表示含物质w的两种溶液,下列说法正确的是( )

-
(1) 如表是KNO3、NaCl在不同温度下的溶解度(单位:g/100g水)
温度(℃)
0
10
20
30
40
50
60
70
80
90
100
KNO3
13.3
20.9
32
45.8
64
85.5
110
138
169
202
246
NaCl
35.7
35.8
36
36.3
36.6
37
37.3
37.8
38.4
39
39.8
Ⅰ.20℃时,NaCl的溶解度是 g.
Ⅱ.30℃时,KNO3溶液的最大浓度(溶质质量分数)为(只列计算式,不需要计算结果).
Ⅲ.KNO3中含少量氯化钠时,提纯硝酸钾的一般方法是.
Ⅳ.根据表内数据可知,KNO3和NaCl在某一温度时具有相同的溶解度X,则X的取值范围是.
-
(2) 如图是对20℃一定质量的甲的溶液进行恒温蒸发结晶的实验过程,请回答.

Ⅰ.蒸发前原溶液是(填“饱和”或“不饱和”)溶液.n的数值是.
Ⅱ.依据上述实验,你认为甲的溶解度随温度变化的趋势是(填字母).
A.随温度升高而增大 B.随温度升高而减小 C.无法判断.
-
(1) 汽油能洗涤油污,这是利用汽油油污的性质;
-
(2) 铝块可以加工成铝箔,主要利用铝的性;
-
(3) 湿衣服在夏季比冬季干得快,从微观角度分析其原因是.

-
(1) 蒸发前原溶液是(填“饱和”或“不饱和”)溶液,n 的数值是,该温度下,甲的溶解度是。
-
(2) 依据上述实验,你认为甲的溶解度随温度变化的趋势是( )(填字母)的。A . 随温度升高而增大 B . 随温度升高而减小 C . 无法判断
-
(3) 溶液中溶质质量分数的比较:第 2 个烧杯第 3 个烧杯(填“>”、“=”或“<”)


 2Fe2O3+8HCl↑。某化工厂有5吨“酸洗废液”,经测定其中FeCl2的质量分数为25.4%.计算:
2Fe2O3+8HCl↑。某化工厂有5吨“酸洗废液”,经测定其中FeCl2的质量分数为25.4%.计算:
-
(1) 这些“酸洗废液”中含FeCl2的质量为吨.
-
(2) 这些“酸洗废液”在高温氧化的反应中,最多可以得到多少吨氯化氢气体?(写出计算过程及结果)
-
(1) 生成氧气的质量?
-
(2) 参加反应的氯酸钾的质量?(写出计算过程)
-
(3) 氯化钾溶液的质量?(写出计算过程)

-
(1) 请指出图中两个明显的错误处,并说明改正方法。
错误①:
错误②:
-
(2) 若将(1)中的错误更正后,进行实验,应称量氯化钠的质量是5g;如果向托盘上加氯化钠时,指针偏向分度盘的右边,应进行的操作是。
-
(3) 量取水时,应选用的量筒(从10mL,100mL中选择);量水读数时,量筒必须平放,视线要跟量筒内凹液面的最低处保持水平。
-
(4) E操作的作用是。
-
(5) 若将(1)中的错误更正后重新配制溶液,测得溶液中溶质质量分数小于10%。请你分析可能的原因有(填序号)
①用量筒量取水时俯视读数 ②配制溶液的烧杯用少量蒸馏水润洗
③在托盘天平的左盘称取氯化钠时,游码不在零位置就调节天平平衡,后将游码移动得到读数
④盛装溶液的试剂瓶用蒸馏水润洗 ⑤氯化钠晶体不纯

-
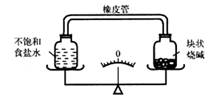
(1) 盐水放置一段时间不会出现浑浊的现象,这是因为。
-
(2) 配制盐水时,需把一包清洗盐全部倒入瓶身,再注满水。清洗盐有 2.7 克和 4.5 克两种规格。当洗鼻器瓶身的体积为 300 毫升时,应选择规格为克的洗鼻盐。
-
(3) 洗鼻器底部有气阀,可以用于控制出水。当阀门打开时,气体进入瓶体,洗鼻器(选填"会"或"不会")出水。


-
(1) 小明认为图甲试管中的溶液为该湿度下硝酸钾的饱和溶液,判断的依据是。
-
(2) 对该试管进行加热(不考虑水的蒸发),得到如图乙所示的溶液,此时溶液中硝酸钾的质量分数是。

-
(1) 判断小明所得③号烧杯溶液是饱和溶液还是不饱和溶液,并说明依据。
-
(2) 已知硝酸钾晶体的溶解度随温度的升高而增大,在不考虑水分蒸发的情况下,配制溶液的过程中,下列操作会使③号烧杯溶液的溶质质量分数偏小的是( )A . 所用硝酸钾晶体中混有少量不溶于水的杂质 B . 加入水时有部分水溅出 C . 添加硝酸钾晶体时有少量残留在称量纸上 D . 配制过程中环境温度升高
-
(3) 在进一步实验中,小明不慎将同桌小科配制的 100 克 10%的硝酸钾溶液当做水倒入③号烧杯溶液中,并得到④号烧杯溶液,计算④号烧杯中溶液的溶质质量分数。(结果精确到 0.1%)

-
(1) 需要称取氯化钠的质量是g,若称量时A出现了右盘略低的现象,接下来的具体操作是。
-
(2) 量取水时,应选用规格为100mL的量筒而不选用200mL的量筒,其目的是 ;
-
(3) C中用玻璃棒搅拌的作用是。
-
(4) 小明同学在实际操作中出现了如下操作,导致配制的氯化钠溶液质量分数偏小的有__________。A . 在托盘天平的左盘称取氯化钠时,游码不在零位置就调节天平平衡,后将游码移动得到读数; B . 氯化钠固体不纯; C . 按照图B的方法读数; D . 将量筒中的水倒入烧杯时,有水洒出;

-
(1) 成分初判:取少量样品粉末放入足量水中,滴加两滴无色酚酞, 有现象出现,证明药品部分变质。
-
(2) 抽样测定:称取 12.4 克样品放入质量为 100 克的锥形瓶中,置于电子秤上,再加入 200 克 7.3%的稀盐酸充分反应,溶液红色逐渐消失,反应结束时电子秤示数如图。 反应后溶液中的溶质为。
-
(3) 计算该样品中 CaCO3的质量。
-
(4) 反应结束后溶液中 CaCl2的质量分数。(精确到 0.1%)



