课题 2 金属的化学性质 知识点题库
下列反应中属于置换反应的是( )
A . 3Fe+2O2 Fe3O4
B . 2H2O
Fe3O4
B . 2H2O  2H2↑+O2↑
C . Fe+CuSO4═FeSO4+Cu
D . NaOH+HCl═NaCl+H2O
2H2↑+O2↑
C . Fe+CuSO4═FeSO4+Cu
D . NaOH+HCl═NaCl+H2O
下列四个图象能正确反映其对应实验操作的是( )
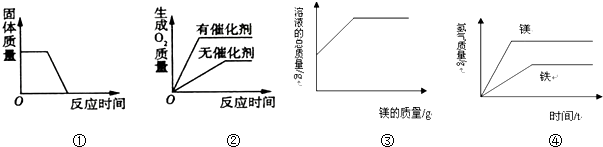
A . ①高温煅烧一定质量的石灰石
B . ②用等质量、等浓度的双氧水分别制取氧气
C . ③向一定质量的硫酸溶液中逐渐加入镁条至过量
D . ④等质量的镁、铁分别与足量的相同的稀盐酸反应
如图是某反应的微观示意图,下列有关说法不正确的是( )

A . 生成的物质都是氧化物
B . 反应前后原子的种类不变
C . 该反应的基本类型属于置换反应
D . 反应前后有两种元素的化合价发生了变化
用数轴表示某些化学知识直观、简明、易记,下列表示错误的是( )
A . 物质形成溶液的pH  B . 化合物中氮元素的化合价
B . 化合物中氮元素的化合价  C . 元素在地壳里的含量
C . 元素在地壳里的含量  D . 铁、铜的金属活动性
D . 铁、铜的金属活动性 
 B . 化合物中氮元素的化合价
B . 化合物中氮元素的化合价  C . 元素在地壳里的含量
C . 元素在地壳里的含量  D . 铁、铜的金属活动性
D . 铁、铜的金属活动性 
根据问题填空:
-
(1) 取少量硫黄与铁粉混合,把混合物放进试管内,用酒精灯加热,当反应后扩展至整支试管时,立即停止加热,静置冷却后观察到生成了黑色固体.

-
(2) 实验室通常用上述反应的生成物硫化亚铁(FeS)固体和稀硫酸在常温下发生复分解反应制取硫化氢(H2S)气体.常温下硫化氢气体是无色、有臭鸡蛋气味的有毒气体,密度比空气大、易溶于水,水溶液是一种酸.请选取合适的制取和收集装置为(填序号).写出利用氢氧化钠溶液吸收硫化氢气体的化学方程式.
下列实验操作或目的不正确的是( )
| 操作 | 目的 |
A | 分别在放有少量铜、银的试管中加入稀盐酸 | 证明铜的金属活动性比银强 |
B | 用玻璃棒蘸取溶液滴到一小片pH试纸上 | 测定溶液的pH |
C | 加热试管里的液体时,试管口不要对着自己或他人 | 防止发生安全事故 |
D | 配制溶液时,用玻璃棒不断搅拌 | 加速溶质的溶解 |
A . A
B . B
C . C
D . D
某化学小组利用CuSO4、FeSO4的混合溶液进行如下探究实验.
-
(1) 写出铝与硫酸铜溶液反应的化学方程式.
-
(2) 向固体A中滴加稀盐酸,若有气泡产生,则A中一定含有的固体有哪些?若无气泡产生,则溶液B中一定含有的溶质有哪些?
-
(3) 在实验时,某同学将铝片放入混合溶液中,发现有一种无色无味气体产生的“异常”现象.他猜想该气体可能为H2、CO2或SO2 . 请分别说明不可能是CO2和SO2的原因.

下列实验方案设计不合理的是( )
A . 用肥皂水鉴别硬水和软水
B . 用稀盐酸除去铁粉中混有少量的铜粉
C . 用pH试纸区别食盐溶液和纯碱溶液
D . 用稀硝酸除去KNO3中混有的K2CO3
“金银铜铁锡”俗称五金,相关叙述错误的是( )
A . 铁锅应用了铁的导热性
B . 金属银可与硝酸铜溶液发生置换反应
C . 金的化学性质最不活泼
D . 焊锡(锡铅合金)比锡熔点低
下列属于置换反应的是( )
A . 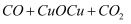 B .
B .  C .
C .  D .
D . 
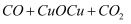 B .
B .  C .
C .  D .
D . 
金属在生产生活中应用广泛。
-
(1) 人们大量使用的是合金,而不是纯金属,这是因为合金具有更多的优良性能,例如,合金的熔点比纯金属的熔点要。
-
(2) 铝、铁、铜是人类广泛使用的三种金属。在这三种金属制品中,使用时最需要注意防止金属被腐蚀的是制品。
-
(3) 细铁丝在氧气中燃烧的方程式为。
-
(4) 将一定量的锌粉加入到硝酸铝、硝酸铜、硝酸银的混合溶液中,充分反应后过滤,向所得滤渣中滴加稀硫酸,有气泡产生。则滤液中含有的溶质是。
某研究小组为验证铁、铜、锌、银的金属活动性顺序,设计如图所示三个实验(三种金属均已用砂纸打磨过,其形状和大小相同,稀盐酸的浓度和用量也相同)。
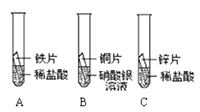
-
(1) 一段时间后,观察到实验B的铜片表面有银白色固体附着,且溶液由无色变为色,这说明铜比银的金属活动性(选填“强”或“弱”),该反应的化学方程式为。
-
(2) 甲同学认为通过实验A和C可比较锌和铁的金属活动性,他依据的实验现象是。
-
(3) 乙、丙两位同学认为仅仅通过上述实验不足以得出四种金属的活动性顺序,因此在上述实验的基础上,两人分别选用不同的金属与不同的化合物溶液,各自补做了一个实验,装置均如下图所示,且都实现了探究目的。

乙同学的实验:X是金属,丙同学的实验:Y是溶液。
化学兴趣小组为了鉴别某黄色金属是黄金还是黄铜(铜锌合金),如下方案不合理的是()
A . 在空气中加热
B . 加入硝酸银溶液
C . 加入氢氧化钾溶液
D . 加入稀盐酸
下图所示的四个图像,分别对应四种过程,其中正确的是( )
A . 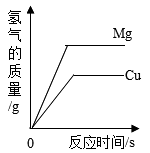 分别向等质量Mg和Cu中加入足量等质量、等浓度的稀硫酸
B .
分别向等质量Mg和Cu中加入足量等质量、等浓度的稀硫酸
B . 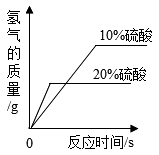 分别向等质量且足量的Zn中加入等质量、不同浓度的稀硫酸
C .
分别向等质量且足量的Zn中加入等质量、不同浓度的稀硫酸
C . 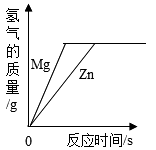 分别向等质量且足量的Mg和Zn中加入等质量、等浓度的稀硫酸
D .
分别向等质量且足量的Mg和Zn中加入等质量、等浓度的稀硫酸
D . 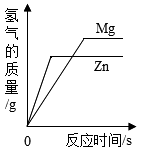 分别向等质量的Mg和Zn中加入等质量、等浓度且足量的稀硫酸
分别向等质量的Mg和Zn中加入等质量、等浓度且足量的稀硫酸
 分别向等质量Mg和Cu中加入足量等质量、等浓度的稀硫酸
B .
分别向等质量Mg和Cu中加入足量等质量、等浓度的稀硫酸
B .  分别向等质量且足量的Zn中加入等质量、不同浓度的稀硫酸
C .
分别向等质量且足量的Zn中加入等质量、不同浓度的稀硫酸
C .  分别向等质量且足量的Mg和Zn中加入等质量、等浓度的稀硫酸
D .
分别向等质量且足量的Mg和Zn中加入等质量、等浓度的稀硫酸
D .  分别向等质量的Mg和Zn中加入等质量、等浓度且足量的稀硫酸
分别向等质量的Mg和Zn中加入等质量、等浓度且足量的稀硫酸
生铁和钢都是由铁和碳组成的合金。为测定某种铁合金中碳的含量,小王同学取一定质量的合金样品盛放在烧杯中,并向其中逐滴加入稀盐酸至恰好完全反应,实验数据如下表所示,请根据相关信息完成下列计算:
|
烧杯质量 |
样品的质量 |
稀盐酸的质量 |
烧杯+剩余物的总质量 |
|
50g |
5.8g |
94.6g |
150.2g |
注:碳既不溶于水也不与稀盐酸发生反应。
-
(1) 铁合金属于材料(填“金属”或“合成”);
-
(2) 样品中碳的质量分数(计算结果保留到 0.1%)。
一定属于置换反应的是( )
A . 将长铁丝伸入氯化银中
B . 将长铁丝伸入硫酸铜溶液中
C . 一种单质和一种化合物的反应
D . 生成一种单质和一种化合物的反应
金属制品与我们的日常生活密不可分。
-
(1) 钢铁是应用最普遍的金属材料,某些铁制零件防锈措施是涂油,其防锈原理是。
-
(2) 铝的化学性质比铁活泼,但是铝制品具有很好的防腐蚀性能,其原因是铝表面容易形成。
-
(3) 为验证Zn、Cu、Ag三种金属的活动性强弱,某同学选用如下试剂组进行验证,其中不合理的一组是
①Zn、CuSO4溶液、Ag ②ZnSO4溶液、Cu、AgNO3溶液 ③Zn、Cu、AgNO3溶液
-
(4) 将一定量的铝、铜粉末混合物加入硝酸银溶液中,充分反应后过滤,滤液为蓝色。滤渣中一定含有,滤液中溶质的组成可能是或(填化学式)。
小亮妈妈要去买热水壶,让小亮上网查一下“高锰钢”与“304不锈钢”热水壶的区别,在査阅过程中,小亮发现“高锰钢”与“304不锈钢”相比,增加了“锰”的含量,且“高锰钢”不宜在酸性环境中使用。好奇的小亮想探究锰(Mn)与常见金属铁、铜的活动性强弱,邀请你一同参加。
-
(1) (作出猜想)
猜想1:Mn>Fe>Cu; 猜想2:Fe>Mn>Cu 猜想3:。
-
(2) (查阅资料)
锰能与稀硫酸反应,生成无色的硫酸锰(MnSO4)溶液。
(设计与实验)
①小亮同学取大小相等的三种金属片,用砂纸打磨光亮;目的是。
②另取三支试管,分别放入等量的同种稀硫酸。
实验步骤
实验现象
实验结论
a、将铁片放入稀硫酸中
铁片表面产生气泡较慢,溶液变为浅绿色
猜想1成立
b、将锰片放入稀硫酸中
锰片表面产生气泡
c、将铜片放入稀硫酸中
-
(3) (知识运用)
小美觉得小亮的实验中稀硫酸溶液替换为FeSO4溶液,也能得到同样的结论,请写出将锰片放入FeSO4溶液中,发生反应的化学方程式为。
根据实验操作所绘制的图象中,正确的是( )
A . 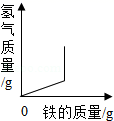 将铁粉加入到一定量的稀盐酸中
B .
将铁粉加入到一定量的稀盐酸中
B .  用一定量的木炭还原氧化铜
C .
用一定量的木炭还原氧化铜
C . 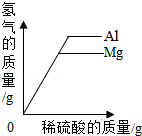 分别向等量的镁、铝中加入等浓度的稀硫酸
D .
分别向等量的镁、铝中加入等浓度的稀硫酸
D .  向盛有MnO2的试管中加入H2O2溶液
向盛有MnO2的试管中加入H2O2溶液
 将铁粉加入到一定量的稀盐酸中
B .
将铁粉加入到一定量的稀盐酸中
B .  用一定量的木炭还原氧化铜
C .
用一定量的木炭还原氧化铜
C .  分别向等量的镁、铝中加入等浓度的稀硫酸
D .
分别向等量的镁、铝中加入等浓度的稀硫酸
D .  向盛有MnO2的试管中加入H2O2溶液
向盛有MnO2的试管中加入H2O2溶液
有X、Y、Z三种金属,如果把X和Y分别放入稀硫酸中,X溶解并产生氢气,Y不反应;如果把Y和Z分别放入硝酸银溶液中,过一会儿,在Y表面有银析出,而Z表面没有变化。根据以上事实,判断这三种金属的活动性由强到弱的顺序为( )
A . Z、Y、X
B . Y、X、Z
C . X、Y、Z
D . Y、Z、X
最近更新



