课题 2 金属的化学性质 知识点题库
[实验探究]可自选试剂,用化学方法探究合金粉末成分.
实验操作 | 实验现象 | 实验结论 |
合金中含有铝、铁 | ||
合金中含有铝、铜 | ||
合金中含有铝、铁、铜 |
 Fe3O4
B . CaCO3
Fe3O4
B . CaCO3  CaO+CO2↑
C . CuSO4+2NaOH=Cu(OH)2↓+Na2SO4
D . C+2CuO
CaO+CO2↑
C . CuSO4+2NaOH=Cu(OH)2↓+Na2SO4
D . C+2CuO  2Cu+CO2
2Cu+CO2
-
(1) 市场有“高钙牛奶”、“加碘食盐”等商品,这里的钙、碘应理解为 (填序号).A . 元素 B . 离子 C . 分子 D . 单质
-
(2) 可用硫酸铜溶液鉴别假黄金(铜锌合金),该反应的化学方程式是.
-
(3) “火立熄”是一种新型的家用灭火用品.“火立熄”接触到火焰3~5秒后炸开,释放的粉末覆盖在燃烧物上,同时放出不可燃气体,使火焰熄灭.“火立熄”的灭火原理是.
【查阅资料】铁的活动性比铜强.
-
(1) 【进行猜想】对三种金属的活动性顺序做出如下猜想:
猜想一:R>Fe>Cu; 猜想二:; 猜想三:Fe>Cu>R
-
(2) 【收集证据】为了验证哪一种猜想成立,甲、乙、丙三位同学分别展开实验探究.
主要操作
主要现象
实验结论
甲
将打磨好的R丝插入盛有硫酸铜溶液的试管中
。
猜想一
正确
乙
将粗细相同打磨好的R丝、铁丝,分别插入体积和溶质质量分数都相同的稀盐酸中
R丝表面产生气泡速率比铁丝表面产生气泡速率(填“快”或“慢”)
丙
将粗细相同打磨好的R丝、铁丝,分别在空气中点燃
R丝在空气中剧烈燃烧,铁丝在
空气中。
写出铁丝在氧气中燃烧的化学方程式。
-
(3) 【交流反思】三位同学交流讨论后认为,比较金属活动性强弱的方法有多种.
【归纳总结】他们总结得出比较金属活动性强弱的常见方法有:
⑴金属与氧气反应的难易和剧烈程度;
⑵金属与酸溶液是否反应或反应的剧烈程度;
⑶金属与是否反应.
 2X+6H2O.下列说法中不正确的是( )
2X+6H2O.下列说法中不正确的是( )
![]()


请回答下列问题
-
(1) 请写出以下物质的化学式:F;G.
-
(2) 化合物H中所含金属元素呈现的化合价为。
-
(3) 反应①的化学方程式为。
-
(4) 反应④的化学方程式为。
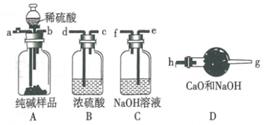
①用足量稀硫酸与已准确称量的纯碱样品作用,使纯碱样品中Na2CO3完全反应放出CO2气体;②当纯碱样品完全反应后,向产生CO2的装置内缓缓鼓入不含CO2的空气,把①产生的CO2 , 全部排入吸收CO2的装置中;③测出被吸收CO2的质量,求出样品中Na2CO3的质量分数。
-
(1) 各仪器连接顺序是(填写各接口的字母):空气→,接,接,接,接,。
-
(2) 装置B的作用是,若没有装置B,会导致测定Na2CO3的质量分数 (填“偏大”“偏小”或“不变”,下同)。
-
(3) 装置C的作用是 ,若没有装置C,会导致测定Na2CO3的质量分数 。
-
(4) 实验操作②中,鼓入空气“缓缓”地进行,其理由是 ,如果这步操作太快,会导致测定的碳酸钠的质量分数。
-
(5) 若样品质量为ng,测得产生CO2的质量为mg,则样品中Na2CO3的质量分数是。

-
(1) 将电路板粉碎成粉末的目的是 。
-
(2) 写出一个步骤①中发生反应的化学方程式 。
-
(3) 第一次过滤后的滤液中的阳离子有。
-
(4) 步骤②的目的是 。
-
(5) 要除去粗铜中的杂质,不能选用 。(选填字母序号)A . 氯化铜溶液 B . 稀盐酸 C . 蒸馏水
 将表面生锈的铁钉放入稀盐酸中
B .
将表面生锈的铁钉放入稀盐酸中
B .  红磷在密闭容器中燃烧
C .
红磷在密闭容器中燃烧
C .  向硫酸铜溶液中加入锌粉
D .
向硫酸铜溶液中加入锌粉
D .  向稀盐酸中滴加硝酸银溶液
向稀盐酸中滴加硝酸银溶液

-
(1) 乙试管中反应的化学方程式为;
-
(2) 同学们经讨论后认为该方案可以优化,试管的实验是多余的,并通过观察实验现象,得出三种金属的活动性由强到弱的顺序为
-
(3) 去掉多余的实验,同学们将另两只试管中反应后的物质倒入同一大烧杯中,一段时间后,过滤,得到滤渣和滤液,然后对滤渣的成分进行如下探究:
【提出问题】烧杯中滤渣的成分是什么?
【实验探究】向过滤得到的滤渣中加稀硫酸,①若无气泡产生,则滤渣的成分是;②若有气泡产生,则滤渣中一定含有。
-
(1) 灯泡里的灯丝用钨制而不用锡制的原因是;
-
(2) 地壳中含量最高的元素是;
-
(3) 波尔多液由硫酸铜、生石灰加水配制而成,配制过程中为什么不能选用铁质容器?(用化学方程式回答)。
-
(4) 世界上铝的年产量仅次于铁,位居第二位。铝制品能被广泛地使用,其中一个原因是铝具有很好的抗腐蚀性能,与气中的氧气反应生成薄膜阻止铝进一步反应,其化学反应方程式为。
①铁钉表面产生气泡 ②液体颜色由无色变成浅绿色 ③铁钉的质量减轻 ④液体的质量减轻
①取大小相同的三种金属片,分别放人CuSO4溶液中,一段时间后,X、Z表面出现红色物质,Y没有变化;②取大小相同的X、Z两种金属片,分别放人相同的稀盐酸中,X、Z表面都产生气泡,但X表面产生气泡的速率明显比Z快。根据以上实验事实,可判断X、Y、Z三种金属的活动性顺序是( )。
| 选项 | A | B | C | D |
| 实验目的 | 探究水对铁钉生锈的影响 | 探究温度是燃烧的必要条件 | 探究金属活动性强弱 | 探究催化剂对反应快慢的影响 |
| 实验设计 | | | | |







