课题 2 金属的化学性质 知识点题库

实验序号 | 实验过程 | 实验现象 |
1 | 5g锌粉与5g铁粉分别与5%盐酸反应 | 锌粉产生气体快 |
2 | 5g铁粉和5g铁片分别与15%盐酸反应 | 铁粉产生气体快 |
3 | 5g铁片分别与5%盐酸和15%盐酸反应 | 15%盐酸产生气体快 |
由此得出影响金属与酸反应快慢的因素有:
a.b.c..
继续探究:
该小组同学将一包铜粉和锌粉的混合物放入一定量的硝酸银溶液中,使其充分反应后过滤,得到滤渣和蓝色滤液,则滤液中一定含有的金属离子是(写离子符号)滤渣中一定含有.
-
(1) 氧气用于炼钢、焊接、切割金属;
-
(2) 用二氧化碳作温室气体肥料;
-
(3) 生石灰用作干燥剂;
-
(4) 用铝合金作厨柜能耐腐蚀。
-
(1) 物质的性质决定物质的用途.由于铜具有良好的性,所以铜常用于制作导线.
-
(2) 常见的三种金属被发现和使用的先后顺序依次为:铜、铁、铝.金属大规模被使用的先后顺序跟下列(填序号)关系最大.
①地壳中金属元素的含量;②金属的熔点;③金属的活动性
-
(3) 铝在空气中表现良好的抗腐蚀性能,用化学方程式表示其原因.
-
(4) 有铜和氧化铜的混合物10g,通入氢气加热至完全反应,冷却后称量剩余固体的质量为8.4g.
①写出氧化铜与氢气反应的化学方程式.
②该混合物中氧化铜的质量为g.
实验步骤 | 实验现象 |
①把甲、乙、丙三种金属分别加入稀硫酸中 | 甲、乙表面有气泡产生,丙无明显变化 |
②再把甲放入到乙的硫酸盐溶液中 | 无明显现象 |
选项 | 实验目的 | 实验方案 |
A. | 证明某气体是一氧化碳 | 将该气体通入灼热的氧化铜粉末,黑色粉末变红 |
B. | 证明酸和碱恰好中和 | 向含有酚酞的氢氧化钠溶液中加入盐酸,溶液最终呈无色 |
C. | 证明燃烧的条件之一是可燃物与氧气接触 | 将白磷放入80℃热水中,不燃烧,通入氧气后白磷燃烧 |
D. | 证明金属的活动性顺序为Fe>Cu>Ag | 将两根光亮铁丝分别伸入硝酸银和硫酸铜的溶液中,硝酸银溶液中的铁丝表面有银白色固体附着,另一铁丝表面有红色固体附着 |
-
(1) 常温下大多数金属都是固体,但体温计中的金属却是液体,该金属是。
-
(2) 铝在空气中与氧气反应,其表面生成一层致密的氧化物薄膜,从而阻止铝进一步氧化。这种氧化物的化学式为。
-
(3) 向含有氯化铜、氯化锌、稀盐酸的混合溶液中加入过量铁粉,充分反应后过滤,滤液中含有的溶质是(写化学式)。
-
(4) 铁矿石有多种,如赤铁矿(主要成分Fe2O3)和磁铁矿(主要成分Fe3O4)等。
①写出赤铁矿石中的主要成分与一氧化碳反应的化学方程式。
②冶炼2900t含四氧化三铁80%的磁铁矿石,理论上能得到含杂质2%的生铁的质量是 t(结果精确到0.1)。
-
(5) 含有锌粉6.5g、铁粉5.6g、铜粉3.2g、铝粉1.8g的混合物与一定质量的稀硫酸充分反应,反应停止后,有6g固体剩余。则生成氢气的质量为g。
|
|
|
|
A.化学反应分类 | B. 物质分类 | C.地壳中元素含量型 | D.金属的化学性质 |

 B . 滤液中一定无
B . 滤液中一定无  C . 滤渣中至少有两种物质
D . 滤渣中滴加稀盐酸,可能没有气泡产生
C . 滤渣中至少有两种物质
D . 滤渣中滴加稀盐酸,可能没有气泡产生

-
(1) 物质C所属的类别是。
-
(2) 写出A与D反应的化学方程式。
-
(3) B与C反应的基本类型是反应。
-
(4) B与E的反应在生产中的用途是。

-
(1) 甲实验中,当向U形管左右两端同时逐滴滴加一定量的氢氧化钠溶液和稀盐酸,开始时,左端溶液呈色,充分反应后U形管中溶液全部变成无色,除酚酞外,写出此时溶液中可能所含溶质的化学式。
-
(2) 乙为验证铝、铜、银三种金属活动性顺序的实验。把打磨光亮的铝片和铜片分别放入盛有溶液的两个试管中,过一会儿观察到试管①中出现的现象,就可证明Al>Cu.为了达到实验目的,试管②中的溶液X为溶液。
-
(3) 丙为探究燃烧条件的实验之一,通过实验可以得出的结论是。
-
(1) “共享单车”方便市民出行,颇受人们的喜爱。

①如图所示,单车上标示出的部件中由金属材料制成的是(填字母序号)。
②为防止钢链条生锈可采取的措施是。
③废旧单车中金属部件回收再利用的意义是(写一点即可)。
-
(2) 将一定量的铜粉放入盛有硝酸锌和硝酸银混合溶液的烧杯中,请写出烧杯中发生反应的化学方程式:。将烧杯中的物质过滤,所得滤液中溶质的组成有种情况。
|
次数 |
1 |
2 |
3 |
4 |
|
稀盐酸质量/g |
50 |
50 |
50 |
50 |
|
氢气质量/g |
0.2 |
0.2 |
0.2 |
0.1 |
请根据有关信息计算该稀盐酸中溶质的质量分数。
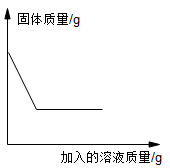
-
(1) (查阅资料)
经查阅,金属铝在常温下能与空气中的氧气反应生成致密的氧化铝薄膜。该反应的化学方程式为 。
-
(2) (对比实验)
编号
操作
现象
甲
将表面未打磨的铝丝浸入CuSO4溶液中
无明显现象
乙
将表面打磨后的铝丝浸入CuSO4溶液中
铝丝表面析出红色固体
丙
将表面未打磨的铝丝浸入CuCl2溶液中
铝丝表面析出红色固体
比较实验乙和实验 (填“甲”或“丙”)可得知:打磨能破坏氧化铝薄膜。
-
(3) 实验乙中反应的化学方程式为 ,据此可知金属活动性Al比Cu (填“强”或“弱”)。
-
(4) 小明同学对实验丙的现象进行分析,认为H2O对氧化铝薄膜有破坏作用。但此观点马上被其他同学否定,否定的依据是 。
-
(5) (猜测与探究)
小组同学针对实验丙的现象,经讨论后猜测:Cl-破坏了氧化铝薄膜。
为检验此猜测是否正确,他们首先向两支试管中加入相同的CuSO4溶液,并均浸入表面未打磨的铝丝,然后进行了新的探究:
操作
现象
结论
推论
(1)向一支试管中再加入
NaCl固体
铝丝表面析
出红色固体
氧化铝薄膜
被破坏
Na+或① 能
破坏氧化铝薄膜
(2)向另一支试管中再加入
Na2SO4固体
②
氧化铝薄膜
未被破坏
Na+和SO42—都不能
破坏氧化铝薄膜
-
(6) (结论与反思)
得出结论:前述猜测 (填“正确”或“不正确”)。总结反思:本次探究充分运用了比较法和控制变量法。