实验活动6 酸、碱的化学性质 知识点题库
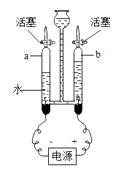
某化学小组在探究碱的化学性质时,做了如图所示的两个实验.

-
(1) 写出A试管中发生反应的化学方程式 .
-
(2) 实验结束后,同学们将A、B两试管中的废液倒入同一洁净的烧杯,烧杯中出现蓝色沉淀.小组同学将烧杯中的物质进行了过滤,对滤液中成分有如下猜想:
【提出猜想】甲:滤液中的溶质是Na2SO4 CuSO4
乙:滤液中的溶质是Na2SO4 H2SO4
丙:滤液中的溶质是
丁:滤液中的溶质是Na2SO4
【交流讨论】同学们对以上的猜想提出质疑,认为猜想 不合理,理由是 .
【设计实验】同学们通过以下的实验对猜想进行验证,请你完成实验报告.
实验内容
预计现象
预计结论
(1)取少量滤液于试管中,观察
溶液呈无色
猜想 不成立
(2)继续在上述试管中加入
产生蓝色沉淀
猜想 成立
①工业上采用液化空气的方法制备氧气和氮气
②氢气、甲烷在点燃前要检验气体的纯度
③一般情况下,合金的熔点和硬度都比组成合金的纯金属高
④氢氧化钠固体潮解、变质与水蒸气和二氧化碳有关
⑤干冰灭火既能降温,又能隔绝空气,而且灭火后不会留痕迹
⑥二氧化硫、氮氧化物、一氧化碳和二氧化碳都是大气污染物.
-
(1) 从分子角度解释气体受热会膨胀.
-
(2) 稀盐酸和稀硫酸化学性质相似的原因.
-
(3) 用化学方程式解释生石灰可做干燥剂的原因.

实验1:
步骤1:在C中加入少量白磷并加入热水,塞好胶塞使导管口进入热水中发现白磷不燃烧;
步骤2:打开K1 , 关闭K2 , 将A中的溶液滴入B中,C中有气泡冒出,白磷燃烧,B中发生的化学方程式为.
通过以上实验研究了燃烧的一个条件.它是.
实验2:研究CO2与NaOH固体的反应
步骤1:A中盛有稀盐酸、B中Na2CO3固体,C中NaOH固体
打开K1 , 关闭K2 , 将A中溶液滴入B中,气球变大,打开K2 , 关闭K1 , 一段时间后气球没有明显变瘪.
步骤2:依据以上实验现象,改进后重新添加药品,进行实验2.
步骤3:打开K2 , 关闭K1 , 将A中液体滴入B中,用燃着的木条放在K2上,发现木条熄灭,问上述操作的目的.然后进行后续实验,说明CO2与NaOH固体发生了反应,后续实验的操作与现象为.
-
(1) 下列金属制品中,利用金属导热性的是 (填字母)A . 金属硬币 B . 铝制导线 C . 铜制火锅
-
(2) 波尔多液是一种农业上常用的杀菌剂,它由硫酸铜、生石灰加水配制而成,不能用铁质容器配制波尔多液的原因是(用化学方程式表示)
-
(3) 防止金属锈蚀是保护金属资源的有效途径之一.洁净的铁钉在下列情况下容易生锈的是 (填字母).A . 在干燥的空气中 B . 在潮湿的空气中 C . 浸没在植物油中
-
(4) 铝具有良好的抗腐蚀性能,原因是铝在空气中与氧气反应,其表面生成一层致密的氧化铝薄膜,从而阻止铝进一步氧化.氧化铝难溶于水,却能溶于酸.写出氧化铝与稀硫酸反应生成硫酸铝和水的化学方程式.
-
(5) 向铁粉和氧化铜粉末的混合物中加入一定量的稀硫酸,微热,充分反应后过滤,得滤渣和滤液.向滤液中加一洁净铁片,未看到铁片有任何变化.则滤液中含有的溶质是(填化学式),滤渣中一定含有的物质是(填化学式)
|
|
|
|
实验1.燃烧条件的实验 | 实验2.铁钉锈蚀条件的探究 | 实验3.电解水实验 | 实验4.氢氧化钠溶液中滴入硫酸铜溶液 |
-
(1) 实验1中,铜片上白磷燃烧而水中白磷没有燃烧,说明。
-
(2) 实验2中,由A、B得出的结论是。
-
(3) 实验3中,a管中的气体是。
-
(4) 实验4中,试管中的现象是。
-
(1) 烹饪中食醋常做调味剂。食醋的主要成分是醋酸,它是一种有机酸。下列有关食醋的说法,正确的是 (填字母)A . pH>7 B . 能软化鱼骨和鸡蛋壳 C . 能与铜、铁等金属反应 D . 能使紫色石蕊试液变红
-
(2) 为了鉴别自来水是硬水还是软水,我们可以选用家中的用品是。
-
(3) 天然气是主要的家用燃气,天然气的主要成分是(填化学式)。

①煅烧石灰石的化学方程式是。
②完成以下实验探究。
| 实验探究 | 实验操作 | 现象 | 结论与理由 |
| 石灰石煅烧生成CO2 | 火焰上方罩洁净的烧杯,而后倒入澄清石灰水 | 澄清石灰水变浑浊 | 有CO2生成;此结论是否正确,并说明理由。 |
| 石灰石煅烧生成CaO |
|
| 有CaO生成 |
| 石灰石部分分解 |
|
| 部分分解 |
-
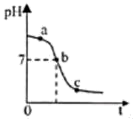
(1) 该反应的化学方程式是。
-
(2) 图中c点溶液中的溶质是。
-
(3) 为了防止c点溶液直接排放污染环境,可以向溶液中加入适量的。

-
(1) 如果A是一种黑色粉末,D是一种红色固体单质,C中溶质由两种元素组成,则A→C反应的化学方程式为。
-
(2) 如果A,B,C,D中都含有钠元素,B的俗名是纯碱,D是食盐的主要成分,B、C、D均为可溶的盐,D中含有两种元素,则A的化学式是,B→D的化学方程式为。

|
温度(℃) |
0 |
20 |
40 |
60 |
80 |
100 |
|
|
溶解度(g) |
NaOH |
31 |
91 |
111 |
129 |
313 |
336 |
|
Ca(OH)2 |
0.19 |
0.17 |
0.14 |
0.12 |
0.09 |
0.08 |
|
-
(1) 从表中数据可以获得的信息是 (写一条)。
-
(2) 把80℃时NaOH的饱和溶液降温至20℃,可以看到的现象是;现有20℃时Ca(OH)2的饱和溶液(甲溶液),向其中加入一定量CaO后得到的溶液(乙溶液),此时溶液的溶质量分数乙甲(填>、<、=),恢复到20℃时溶液的溶质量分数乙甲(填>、<、=)。
-
(3) 某兴趣小组对部分变质的氢氧化钠固体进行提纯,设计了如下操作流程:请回答:

(Ⅰ)步骤②反应的化学方程式为,加入过量Ca(OH)2的目的是 。
(Ⅱ)滤液B中的溶质是和(写化学式);步骤③所包含的具体操作是加热、浓缩、、过滤。
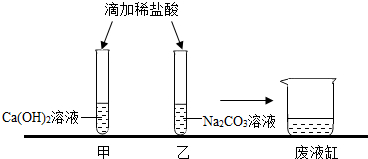
实验结束,甲先将废液缓慢倒入废液缸中;随后乙也将废液缓慢倒入到同一废液缸中。
-
(1) 【观察与分析】乙同学观察到废液缸中先有气泡产生,然后又出现了白色沉淀。产生的气体是;白色沉淀是Na2CO3溶液与溶液反应产生的。
-
(2) 【提出问题】最终废液中含有什么溶质?
【猜想与假设】
猜想一:废液中含有NaCl、CaCl2两种溶质;
猜想二:废液中含有NaCl、Na2CO3两种溶质;
猜想三:废液中含有NaCl、HCl两种溶质。
【实验设计与探究】
实验方案
实验现象
结论
甲
取少量废液于试管中,向其中滴加Na2CO3溶液
无明显现象
猜想一、三不成立,猜想二成立
乙
取少量废液于试管中,向其中滴加CaCl2溶液
出现白色沉淀
猜想一、三不成立,猜想二成立
【反思与评价】
①【猜想与假设】中,猜想是不合理的。猜想也不完整,请补充猜想四:。
②老师认为甲同学的【实验设计与探究】结论实际上是不合理的,理由是。