实验活动6 酸、碱的化学性质 知识点题库
充有的蒸汽的高压钠灯发出的黄光射程远,透雾能力强,常用于道路和广场的照明.钠的化学性质活泼,常温下可以与氧气、水反应,在实验室里,金属钠保存在煤油中,用镊子从煤油中取出金属钠,放在滤纸上,用小刀切下一小块,投入盛有水(滴有酚酞溶液)的烧杯中,发现钠块浮在水面上,很快熔化成银白色小球,四处游动,发出嘶嘶的响声,偶有火星出现,溶液变成红色.依据提供的信息,回答下列问题.

-
(1) “钠保存在煤油中”说明钠具有的化学性质是.
-
(2) “钠块浮在水面上”说明钠具有的物理性质是.
-
(3) “溶液变成红色”说明钠与水反应的生成物中含有性的物质.
-
(4) 根据所学知识解释钠“熔化成银白色小球”的原因是.
请回答下列问题:
-
(1) 鸭蛋中富含的营养素有水和.
-
(2) 生石灰加入沸水中,水能持续保持沸腾,其原因是.
-
(3) 静置后,取少量的上层料液,稀释后滴加无色酚酞试液,料液应变为色.
-
(4) 同学们对上层料液的成分产生了兴趣,请你一起参与他们的探究活动.
【提出问题】料液中含有哪些溶质?
【交流讨论】①一定含有NaOH,NaCl;
②可能还含有其它溶质,
甲同学推断只有Ca(OH)2 ,
乙同学推断只有Na2CO3 ,
丙同学推断既有Ca(OH)2 , 也有Na2CO3;
通过进一步讨论,大家一致认为丙同学的推断是错误的,理由是(用化学方程式表示).
【实验探究】
实验步骤
实验现象
取少量上层料液,滴加稀盐酸
无明显现象
另取少量上层料液,滴加碳酸钠溶液
产生白色沉淀
【探究结论】同学的推断是正确的.
【知识应用】①皮蛋食用时加入一些食醋,可以去除氨味和涩感,原因是.
②料液中起主要作用的是烧碱,现行配方中,直接用烧碱代替石灰和纯碱作用生成的烧碱,若加工10kg的鸭蛋,需要烧碱的质量是多少千克?(请写出计算过程).
 比较 MnO2和 Fe2O3的催化效果
B .
比较 MnO2和 Fe2O3的催化效果
B .  制取并收集CO2气体
C .
制取并收集CO2气体
C .  证明 CO2和 NaOH已发生反应
D .
证明 CO2和 NaOH已发生反应
D .  形成蓝色喷泉
形成蓝色喷泉
选项 | 实验目的 | 实验方案 |
A | 区别羊毛和棉花 | 燃烧法 |
B | 除去HCl气体中少量的CO2 | 通过生石灰 |
C | NaOH固体中混有少量CaCO3 | 加入足量的水、溶解、过滤、蒸干 |
D | 验证NaCl溶液中混有盐酸 | 取少量溶液,滴加紫色石蕊溶液 |
选项 | 物质(括号内为杂质) | 试剂 | 操作方法 |
A | CO2(SO2) | 适量NaOH溶液 | 洗气 |
B | K2SO4(KOH) | 适量HCl溶液 | 蒸发 |
C | CO2(CO) | 足量O2 | 点燃 |
D | FeCl2(CuCl2) | 足量铁屑 | 过滤、蒸发 |
选项 | 实验目的 | 实验操作 |
A | 除去氧气中少量的水蒸气 | 通过盛有浓硫酸的洗气瓶 |
B | 除去NaCl溶液中的Na2CO3 | 加适量稀硫酸 |
C | 鉴别①CuSO4溶液 ②FeCl3 溶液 ③NaCl溶液 ④NaOH溶液 | 不加其它试剂,利用组内物质的颜色和相互反应进行鉴别 |
D | 除去稀盐酸中混有的少量硫酸 | 加入适量的BaCl2溶液,再过滤 |
选项 | 物质 | 所选试剂及操作方法 |
A | Cu(CuO) | 通入氧气并加热 |
B | CO2(HCl) | 气体通过盛有足量氢氧化钠溶液的洗气瓶 |
C | N2(O2) | 气体通过炽热的铜粉 |
D | KCl溶液(K2CO3) | 加入过量氯化钙溶液充分反应后过滤 |

已知:步骤I无蓝色沉淀生成。
-
(1) Ca(OH)2的俗名为;稀硫酸的工业用途有:(举一例即可)。
-
(2) 步骤Ⅱ和步骤Ⅲ都需进行的操作是,该操作常用的玻璃仪器除玻璃棒、烧杯外,还有;玻璃棒作用。
-
(3) 步骤Ⅱ得到金属铜的反应的化学方程式为。
-
(4) 步骤Ⅰ中加入少量Ca(OH)2最终目的是。
-
(5) 步骤Ⅲ需加入Na2S才能使废水达到排放标准。从微观角度看,溶液中实际发生的反应为:Cu2+ += CuS↓

-
(1) 初中化学课上,同学们利用如图实验探究碱的化学性质

①A实验中滴加酚酞的作用是:;
②B实验中观察到的现象为:;
③C实验中反应的化学方程式为:。
-
(2) 【实验再探究】实验结束后,同学们将废液倒入同一只废液缸中,发现废液浑浊并显红色。
【提出问题】废液中含有什么物质?
【假设猜想】通过分析上述实验,同学们猜想:废液中除酚酞、碳酸钙及水以外一定含有。
老师问:废液中还可能含有什么物质?引发了同学们热烈讨论,下面是大家的发言:
学生甲
可能含有Ca(OH)2
学生乙
可能含有Na2CO3
学生丙
可能含有CaCl2
学生乙
可能含有
-
(3) 【实验验证】同学们对可能含有的物质进行确定,取一定量的废液过滤,向滤液中逐滴加入氯化钡溶液,得到白色沉淀,红色褪去。
【结论】上述滤液中,还含有,没有。
-
(4) 【实验反思】
①根据以上B实验可知,氢氧化钠溶液露置于空气中容易变质,请写出相关反应的化学方程式:;
②现有一瓶长期敞口放置的氢氧化钠溶液,它的变质程度如何呢?
-
(5) 【查阅资料】Ⅰ氯化钙溶液呈中性。
Ⅱ氯化钙溶液能与碳酸钠溶液反应:CaCl2+Na2CO3═CaCO3↓+2NaCl
为了弄清久置的氢氧化钠是否完全变质,设计了如下方案:
实验步骤
实验现象
实验结论
①取少量该溶液于试管中,向溶液中滴加过量的氯化钙溶液,并不断振荡
有生成
说明原溶液中一定有碳酸钠
②取步骤①试管中的少量上层清液,滴加酚酞溶液
溶液变红色
说明原溶液中一定有
-
(6) 【实验结论】
该氢氧化钠溶液(填“部分”或“全部”)变质。
-
(7) 【反思与评价】
在上述实验步骤①中,小强提出可用氢氧化钙溶液代替氯化钙溶液,你认为该方案(填“可行”或“不可行”)。
![]()
-
(1) C物质的化学式是。
-
(2) A→B化学方程式为;
-
(3) B→D化学方程式为,该反应能够发生的原因是。

资料:
 ,两电极,一端得到NaOH和
,两电极,一端得到NaOH和  ,另一端得到
,另一端得到  。
。
-
(1) 晾晒海水得到粗盐的原理是。
-
(2) 实验室蒸发用到的仪器有铁架台(带铁圈)、坩埚钳、石棉网、酒精灯、玻璃棒和。
-
(3) 工业生产中应选择途径(“①”或“②”),理由是。
-
(4)
 可用于生产84消毒液(有效成分
可用于生产84消毒液(有效成分  ),反应原理为
),反应原理为 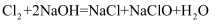 ,反应前后氯元素的化合价有种。
,反应前后氯元素的化合价有种。
-
(5) 图1实验测定水的组成,不能加入NaCl增强水的导电性的理由是。
-
(6) 图2实验获得84消毒液,直流电源正极应与(填“a”或“b”)连接,才能使
 的含量更高。
的含量更高。 
-
(1) NaOH溶液和稀硫酸反应,向滴有酚酞的NaOH溶液中加入稀硫酸,现象为,反应的化学方程式为。
-
(2) 为除去NaCl中混有的少量Na2SO4 , 某探究不组设计了如图所示方案进行实验:

①Ⅰ、Ⅱ两步都有过滤操作,过滤中要用到的玻璃仪器有。
②甲、乙同学选用的X分别为BaCl2溶液、Ba(OH)2溶液,写出Ⅰ、Ⅱ两步中发生的任意一个反应的化学方程式,甲、乙同学的实验中,可能发生的相同反应的化学方程式为,乙的实验中,步骤Ⅲ涉及的操作和现象是。
③丙同学认为甲的实验比乙的实验更合理,理由是。

试分析:
-
(1) 气体X是
-
(2) 加入过量的盐酸目的是
-
(3) 溶液A中的阳离子是(填离子符号)
-
(4) 整个工艺流程中涉及到的化学反应有个(填数字)。

-
(1) 任务一:判断稀硫酸与下列四种化合物溶液是否发生反应。
(实验1)分别取少量四种化合物溶液1~2mL于试管中(如图1所示),分别滴加几滴稀硫酸。

(交流总结)
B试管中发生了反应,产生的现象是。
-
(2) C试管中也发生了反应,发生反应的化学方程式是。
-
(3) 任务二:探究无明显现象的反应是否发生。
(实验2)A试管中没有现象,为了验证发生了反应,同学们又进行了实验(如图2所示)。由此现象可得到的结论稀硫酸和氢氧化钠发生了反应。判断依据是。

-
(4) (能力提升)
①A试管中发生中和反应,其实质是。
②D试管中没有发生反应的原因是。
-
(5) 任务三:探究图2所得溶液中溶质成分。
(猜想与假设)小红认为图2恰好反应。小明认为稀硫酸有剩余,理由是。
-
(6) (反思交流)针对上述猜想,同学们分享交流了不同实验都能证明稀硫酸有剩余,请你写出其中一种方法对应反应的化学方程式:。


-
(1) 在图一所示的实验中,试管②中发生反应的化学方程式是。
-
(2) 甲烧杯中的物质完全反应后,发现红色固体物质明显增多。下列说法正确的是____(填序号)。A . 试管②反应后的固体中一定不含铁 B . 完全反应后,甲烧杯中的固体一定含有铁 C . 完全反应后,甲烧杯的溶液中可能含有Cu2+ D . 完全反应后,甲烧杯的溶液中一定含有Mg2+、Fe2+
-
(3) 乙烧杯中的物质充分反应后,仅观察到有白色沉淀,无其他现象。则试管④反应后的溶液中的溶质共有哪些(写化学式)
-
(4) 将乙烧杯内的物质进行过滤,对所得滤液中溶质成分进行了如下探究:
实验操作
实验现象
实验结论
步骤1:取少量滤液于试管中,向其中滴加足量硝酸钡溶液
有白色沉淀生成
①生成的白色沉淀是(写化学式,下同)
步骤2:静置,向上层清液中滴加无色酚酞试液
溶液变红
②滤液中的溶质共有那些:。
-
(5) 在上述(4)的实验探究中、步骤1中加入足量硝酸钡溶液的目的是。



