第4章 认识化学变化 知识点题库
某课外小组对氧化铜和铜的混合物成分进行探究。称取10g此样品,加入一定量的稀硫酸使之恰好完全反应,过滤后得到2g滤渣和溶质质量分数为10%的滤液。
-
(1) 计算该样品中氧化铜的质量分数。
-
(2) 根据化学方程式计算所得滤液中溶质的质量。
-
(3) 计算所加入的稀硫酸的溶质质量分数?(计算结果精确到0.1%)
在100 g的某盐酸中加入硝酸银溶液,反应为AgNO3+HCl=HNO3+AgCl↓,至恰好完全反应,经过滤、洗涤、干燥、称量得到质量为28.7
g的AgCl沉淀,求盐酸的溶质质量分数。
从安全的角度考虑,下列说法错误的是( )
A . 家用汽车引擎失火时,立刻打开车前盖
B . 冬季用煤炉取暖时,要保持良好通风
C . 误食重金属盐后,应立即喝牛奶、蛋清并送医院就医
D . 厨房燃气管漏气,立即关闭阀门并开窗通风
浓硫酸所贴的危险化学品标志是( )
A .  B .
B .  C .
C .  D .
D . 
 B .
B .  C .
C .  D .
D . 
一定条件下,在一个密闭容器内发生某反应,测得反应过程中各物质的质量如图所示,下列说法错误的是( )
| 物质 | X | Y | Z | W |
| 反应前质量/g | 10 | 3 | 90 | 0 |
| 反应后质量/g | 4 | 3 | 待测 | 5 |
A . 该反应为分解反应
B . Y可能是催化剂
C . 反应中X和W的质量变化之比为6:5
D . 物质X可能是单质
某气体可能由一种或多种常见的气体组成,经测定其中只含有碳、氧两种元素,碳、氧元素的质量比为 1:2,某组同学探究该气体组成情况,以下结论你认为正确的是( )
A . 该气体一定是 CO,CO2 的混合气体
B . 该气体中可能含有三种物质
C . 该气体中一定含有 CO 气体
D . 该气体中不可能混有氧气
测定大理石含CaCO3的质量,取大理石样品12.5g,加入盛有100g稀盐酸的烧杯中,两者恰好完全反应(假设其他杂质不与盐酸反应,也不溶解),烧杯内物质的质量变为108.1g。试计算:
-
(1) 产生二氧化碳气体的质量;
-
(2) 大理石样品中CaCO3的质量。
初中化学教科书中的一些实验如下图所示。回答下列问题:
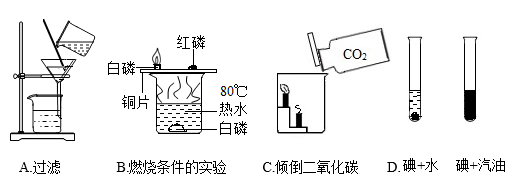
-
(1) A实验中玻璃棒的末端要靠在过滤后滤液仍浑浊,可能的一种原因是 。
-
(2) B实验中红磷没有燃烧,原因是,该实验的不足之处是 。
-
(3) C实验验证了二氧化碳具有的化学性质;
-
(4) D实验能得出的实验结论是 。
取一定质量的CaCO3高温加热一段时间后,冷却,测得剩余固体的质量为8.0g,剩余固体中钙元素质量分数为50%。下列判断正确的是( )
A . 生成2.0gCO2气体
B . 原来CaCO3的质量为143g
C . 生成5.6gCaO
D . 剩余CaCO3的质量为3.0g
化学就在我们身边,厨房及饮食中蕴藏着许多化学知识。
-
(1) 加碘食盐中的“碘”是指(填“元素”、“分子”、“原子”或“单质”)。
-
(2) 举一厨房中发生的变化属于缓慢氧化的实例:。
-
(3) 多喝硬水易得白内障,生活中可通过的方法降低水的硬度。
-
(4) 食品包装袋中常充氮气以防腐,是由于氮气的化学性质。
-
(5) 将汽水瓶振荡产生的气体通入紫色石蕊试液中,溶液变红,其原因是(填写符号表达式)。
火是文明的起源,取火的方法,经历了漫长的演变过程。
-
(1) 古代人使用的“火折子”吹气即可燃,“火折子”的制作材料中有硫磺。硫燃烧的化学反应方程式为。
-
(2) 1830年,法国人发明了摩擦火柴,将白磷、硫、KClO3、MnO2混合做火柴,摩擦生热使白磷燃烧,利用白磷燃烧的热量使KClO3分解,然后是硫燃烧。该过程中KClO3分解的化学反应方程式为。
-
(3) 19世纪中期,瑞典人创造出安全火柴,将红裤涂在火柴盒的摩擦面上,硫、KClO3、MnO2则藏于火柴头中。火柴划燃的瞬间,火苗异常旺,对产生此现象的原因推测不合理的是(填序号)。
A火柴头里的硫比火柴梗燃烧更剧烈
B MnO2分解产生氧气助燃
C KClO3分解产生氧气助燃
钠是一种非常活泼的金属,它可以和冷水直接反应生成氢氧化钠和氢气,但是它与煤油不会发生反应。把一小块银白色的金属钠投入盛有蒸馏水的烧杯中(如图a所示)。可以看到钠块浮在水面上,与水发生剧烈反应,反应放出的热量使钠熔成小球,甚至会使钠和生成的氢气都发生燃烧。如果在上述盛蒸馏水的烧杯中先注入一些煤油,再投入金属钠,可以看到金属钠悬浮在煤油和水的界面上(如图b所示),同样与水发生剧烈的反应,但是不发生燃烧。
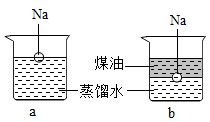
-
(1) 钠和水反应的文字表达式为 。
-
(2) 氢氧化钠是一种碱,能让无色酚酞变为红色。如果预先在a烧杯中滴加几滴酚酞试液,实验中可以看到液体颜色由色变为色。
-
(3) 在第二个实验中,钠也与水发生反应,但不发生燃烧,猜想这是因为。
-
(4) 在第一个实验中,钠浮在水面上;在第二个实验中,钠悬浮在煤油和水的界面上。这两个现象说明了。
甲、乙、丙、丁四种物质在反应前后的质量关系如图所示,下列有关说法错误的是( )
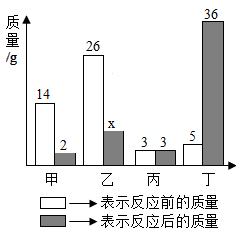
A . 参加反应的甲和乙质量比为2:7
B . 丙可能是该反应的催化剂
C . 丁一定是化合物
D . x的值是7
某同学在做“铁丝在氧气中燃烧”的实验时,没有看到剧烈燃烧、火星四射的现象,导致实验失败的原因可能是( )
A . 没有将细铁丝绕成螺旋状
B . 用排气法收集的氧气没有集满
C . 在集气瓶底铺了一层细沙
D . 将细铁丝表面的油污擦净
金属X与Cu(NO3)2溶液反应的化学方程式为
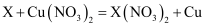 , 则下列说法不正确的是( )
, 则下列说法不正确的是( )
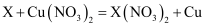 , 则下列说法不正确的是( )
, 则下列说法不正确的是( )
A . 该反应是置换反应
B . 金属X的活动性比Cu强
C . 金属X可能是铝
D . 该反应前后X的化合价发生了变化
黑火药是中因四大发明之一,其主要反应为 。下列说法正确的是( )
。下列说法正确的是( )
 。下列说法正确的是( )
。下列说法正确的是( )
A . X的化学式为2N
B . 参加反应的碳、硫质量比为3:1
C . KNO3中氮元素的化合价为+3
D . CO2中的“2”表示一个二氧化碳分子中含有2个氧原子
已知Na2CO3和盐酸反应生成CO2是分两步完成的。向Na2CO3和NaHCO3的混合溶液中,逐滴加入质量分数为10%的稀盐酸,产生CO2的质量如图所示。下列说法错误的是( )
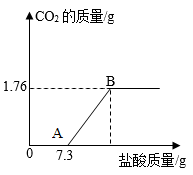
A . 0→A发生的反应为: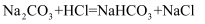 B . A→B发生的反应为:
B . A→B发生的反应为: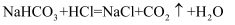 C . 原混合液中Na2CO3的质量为2.12g
D . 原混合液中NaHCO3的质量为3.36g
C . 原混合液中Na2CO3的质量为2.12g
D . 原混合液中NaHCO3的质量为3.36g
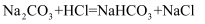 B . A→B发生的反应为:
B . A→B发生的反应为: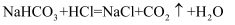 C . 原混合液中Na2CO3的质量为2.12g
D . 原混合液中NaHCO3的质量为3.36g
C . 原混合液中Na2CO3的质量为2.12g
D . 原混合液中NaHCO3的质量为3.36g
取16g大理石(大理石中的杂质不溶于水,也不与酸发生反应)与100g稀盐酸恰好完全 反应,生成4.4g二氧化碳。试计算并写出计算过程:
-
(1) 大理石中碳酸钙的质量分数是多少?
-
(2) 反应后所得溶液中溶质的质量分数为多少?(计算结果保留至0.1%)
某化学兴趣小组时学对家中“管道疏通剂”进行下列探究:


“管道疏通剂”包装袋上相关信息如图。
查阅资料:铝和氢氧化钠固体遇水反应放出大量的热,能加快氢氧化钠对毛发等淤积物的腐蚀,同时产生的气体能增加管道内的气压,利于疏通。该反应的化学方程式为: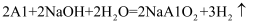 。(注:NaAlO2名称为偏铝酸钠,溶液显碱性,)
。(注:NaAlO2名称为偏铝酸钠,溶液显碱性,)
-
(1) 该疏通剂与水反应产生的在空气中遇到明火可能会引起爆炸。该疏通剂需密封保存的原因是成分中的(填化学式)会与空气中有关物质发生反应,其中发生化合反应的化学方程式为。
-
(2) 小华使用该疏通剂疏通某塑料软管时发现软管变形,原因可能是(写出一个即可),
-
(3) 活动二:探究成分作用
小夏取少量该疏通剂加入适量水,充分反应后,无固体残留,说明疏通剂中一定已完全反应。取少量反应后溶液,向其中滴入1滴酚酞试液,可观察到溶液呈色。
-
(4) 该疏通剂中含有硝酸钠,硝酸钠中氮元素的化合价为。硝酸钠与氢氧化钠和铝粉均不反应,同学们对于疏通剂中硝酸钠的作用感到好奇。通过科学方法检验、该疏通剂与水反应前后硝酸钠的质量和化学性质均没有改变。由此,小夏猜测:硝酸钠可能是铝粉和氢氧化钠溶液反应的催化剂。为判断该猜测是否符合题意,请你设计一个实验方案:。(实验方案包括操作、现象和结论。可选用的试剂有:铝粉、氢氧化钠溶液,硝酸钠粉末)
-
(5) 活动三:开展定量分析
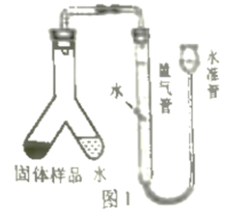
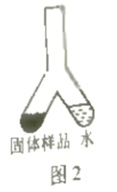
小文设计了图1装置测定该疏通剂样品中铝粉的质量分数。将300mg固体样品和足量水分别放在Y形管两侧,倾斜Y形管,将水倒入左侧:充分反应后,冷却到室温,利用量气管和水准管测定反应生成的氢气体积为100mL。已知该条件下氢气密度为0.09mg/mL。请计算样品中铝粉的质量分数。(写出计算过程)。
-
(6) 小明设计了不同的实验方案,装置如图2,精确称量了该装置在反应前后的质量,将其质量差作为生成氢气的质量,由此计算出样品中铝粉的质量分数。小明和小文测定过程均操作规范,小明测定的样品中铝粉的质量分数却比小文大,原因可能是。
持续防疫,化学助力。
-
(1) 制备“84”消毒液的有效成分次氯酸钠的方法:2NaOH+Cl2=NaClO+X+H2O,则X的化学式是。
-
(2) 在抗击新冠肺炎疫情中,酒精是一种常用的消毒剂。酒精(C2H6O)是(填 “无机物”或“有机物”),其中氢元素的存在形态是(填“游离态”或“化合态”),该物质中氢氧元素的质量比是,0.5molC2H6O中含有个碳原子。
最近更新



