第4章 认识化学变化 知识点题库
将12.5g石灰石(杂质不与酸反应也不溶于水),加入到装有200g稀盐酸的烧杯中。恰好完全反应后,烧杯中物质的总质量为203.7g。请计算:
-
(1) 生成二氧化碳的质量。
-
(2) 稀盐酸中溶质的质量分数。
从化学的角度看,下列说法中正确的是( )
A . 用氢氧化钠溶液除铁锈
B . 夜间煤气泄漏,立即开灯检查
C . 用小苏打作药剂可以治疗胃酸过多症
D . 电器着火,应立即用水灭火
已知A,B,C,D四种物质间能发生化学反应“A+B  C+D ”,则下列说法不合理的是( )
C+D ”,则下列说法不合理的是( )
 C+D ”,则下列说法不合理的是( )
C+D ”,则下列说法不合理的是( )
A . 若反应属于置换反应,则C,D是单质和化合物中的一种
B . 反应可能是“SO2+2NaOH=Na2SO3+H2O”
C . 该反应中A,B,C,D四种物质可能分别属于四类物质
D . 该反应能发生的条件是: C和D有一种是沉淀或是气体或是水
要用溶质质量分数为19.6%的稀硫酸与金属锌反应制取氡气,请回答下列问题
-
(1) 用水和浓硫酸来配制500g溶质质量分数为19.6%的稀硫酸。需溶质质量分数为98%的浓硫酸的质量为g;
-
(2) 配制溶液时,用玻璃棒不断搅拌,玻璃棒的作用是;
-
(3) 取配制后的溶液50g与足量的金属锌反应,生成氢气的质量为g。
硝酸是一种重要的酸,可用于生产化肥、染料和炸药。工业上利用氮的氧化物、氧气与水反应制备硝酸。
-
(1) 某常见氮的氧化物中N、O两种元素的质量比为7:16,则该化合物的化学式为。
-
(2) 将该氮的氧化物23.0g与足量的氧气缓慢通入一定量水中(NO2+O2+H2O→HNO3),得到60.0g硝酸溶液溶液的溶质质量分数为多少?(写出计算过程)
-
(1) 用数字和化学用语填空:
①2个氮原子,②3个碳酸根,
③过氧化氢中氧元素的化合价,④“曾青得铁则化为铜”的化学方程式。
-
(2) 水是宝贵的自然资源。
①河水和海水一样都是混合物。自来水厂利用河水生产饮用水的过程中常用活性炭的性来除去水中的色素和异味;检验饮用水是软水还是硬水,可用来检验。
②科学研究证明,水在光照和TiO2作催化剂的条件下,能分解为氢气和氧气,反应的化学方程式是 。
下列化学方程式书写以及对反应的认识均正确的是( )
A . 一氧化碳还原氧化铁:Fe2O3+3CO═2Fe+3CO2 ;实验时先通CO再点燃酒精喷灯
B . 检验二氧化碳:CO2+Ca(OH)2═CaCO3↓+H2O;该反应属于复分解反应
C . 生石灰与水混合:CaO+H2O ═Ca(OH)2 ;该反应会放出大量热
D . 氯化铁溶液与氢氧化钠溶液反应:FeCl3 +3NaOH═Fe(OH)3+3NaCl;产生红褐色沉淀
下列不属于缓慢氧化的是( )
A . 醋的酿造
B . 火药爆炸
C . 人的呼吸
D . 食物腐败
逻辑推理是化学学习常用的思维方法,下列推理正确的是( )
A . 化合物中含不同种元素,所以含不同种元素的纯净物一定是化合物
B . 金属能够导电,所以能够导电的物质一定是金属
C . 铁丝在空气中不能燃烧,所以铁丝在氧气中也不能燃烧
D . 发光放热的剧烈的氧化反应是燃烧,所以燃烧一定需要氧气
水是生命之源,根据所学知识回答下列问题:
-
(1) 从宏观上看水是由组成,从微观上看水是由构成。
-
(2) 用肥皂水鉴别出软水的现象为,自来水厂的净水过程(填“能”或“不能”)把硬水转化成软水。
-
(3) 某工厂需要160kg氧气作原料,若用电解水的方法制取这些氧气,消耗水的质量是多少?
如图所示,2个甲分子反应生成1个丙分子和3个乙分子,下列判断错误的是( )

A . 该反应的基本反应类型是分解反应
B . 该化学反应中原子的种类发生了改变
C . 参加反应的甲物质属于化合物
D . 根据质量守恒定律可推知,1个乙分子中含有2个A原子
在学习质量守恒定律的内容时,某同学做了如图所示的实验,回答下列问题:
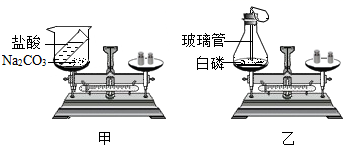
-
(1) 图甲中反应后天平的指针(选填“偏左”、“偏右”或“不变”),发生的化学反应方程式为。
-
(2) 图乙中在实验设计时,锥形瓶底放层细沙的原因是;玻璃管上方系一瘪气球的目的是。
-
(3) 由质量守恒定律可知,化学反应前后,一定不变的是(填序号)。
①原子种类;②原子数目;③分子种类;④分子数目;⑤元素种类;⑥物质总质量
学好化学,科学防疫。根据所学知识回答下列问题。
-
(1) 过氧乙酸是一种有效的新型冠状病毒消毒试剂。教室里喷洒过氧乙酸消毒液后,同学们能够闻到特殊气味,说明分子具有的性质是。
-
(2) 用于手部消毒的医用酒精是体积分数为75%的酒精溶液。
①用医用酒精喷洒手部消毒时,要远离火源。酒精(化学式为C2H6O)在空气中燃烧生成水和二氧化碳,反应的符号表达式为。
②储存酒精的仓库,要张贴的安全标志是(填字母序号)。

-
(3) 均衡摄入各种营养物质(元素),有利于提高人体的免疫力。下列元素中,与人体甲状腺健康关系最密切的是A . Ca B . I C . Zn D . Se
请用所学化学知识解答下列问题:
硫在空气中燃烧发出淡蓝色火焰,在纯氧中燃烧发出蓝紫色火焰,说明燃烧现象与有关;
煤块经粉碎处理后燃烧的更充分,这是因为;
扑灭森林大火时通常会砍出隔离带,采用的灭火原理是。
天然气的用途非常广泛,可作为燃料直接使用。
-
(1) 其燃烧的化学方程式为;我国北方冬季提倡“农村煤改气取暖”,有些人认为燃烧天然取吸效果不如燃煤取暖效果好;研究人员给出资料:标准煤的热值为700kcal/kg,甲烷的热值为1400kcal/kg;并且测定了天然气在不同设备中燃烧产生的污染物的含量,几种常见设备中天然气燃烧时产生的污染物(kg/Mm3)如图所示:

-
(2) 分析图表可知,在常见设备中的使用中天然气燃烧效率最低。
-
(3) 同时提醒我们,为提高天然气燃烧效率,在家中使用天然气灶具时要适当(填增大或调小)进风孔。
如图为探究燃烧条件的实验装置。请回答下列问题:

-
(1) 能够得出燃烧条件之一为“温度达到着火点”的实验现象是什么?
-
(2) 烧杯中热水的作用是什么?
下列图像不能正确反映其对应变化关系的是( )
A . 水电解时生成氢气和氧气的体积 B . 向稀盐酸中加入Na2CO3溶液
B . 向稀盐酸中加入Na2CO3溶液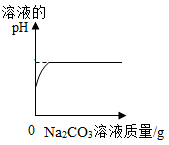 C . 向氯化镁和盐酸的混合溶液中逐滴滴加氢氧化钡溶液
C . 向氯化镁和盐酸的混合溶液中逐滴滴加氢氧化钡溶液 D . 向等质量的镁片和铝片中,分别加入过量的等溶质质量分数的稀盐酸
D . 向等质量的镁片和铝片中,分别加入过量的等溶质质量分数的稀盐酸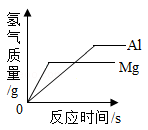
 B . 向稀盐酸中加入Na2CO3溶液
B . 向稀盐酸中加入Na2CO3溶液 C . 向氯化镁和盐酸的混合溶液中逐滴滴加氢氧化钡溶液
C . 向氯化镁和盐酸的混合溶液中逐滴滴加氢氧化钡溶液 D . 向等质量的镁片和铝片中,分别加入过量的等溶质质量分数的稀盐酸
D . 向等质量的镁片和铝片中,分别加入过量的等溶质质量分数的稀盐酸
将40g溶质质量分数为98%的浓硫酸和3.2g铜粉在烧瓶内混合,加热一段时间后,固体完全溶解,得到溶液的质量为40g。请计算:
-
(1) 生成SO2的质量为g。
-
(2) 反应后溶液中硫酸铜的质量分数。(温馨提示:
 )。
)。
以含铜酸性废水(主要溶质为CuSO4、H2SO4)为原料回收金属Cu的一种工艺流程如下:

已知:硫化除铜时,溶液的pH会随着Na2S的加入量增多而逐渐增大。当溶液的pH<3.13时,发生的主要反应是  ,当溶液的pH>3.13时,发生的主要反应是
,当溶液的pH>3.13时,发生的主要反应是  。
。
-
(1) “硫化除铜”时,溶液中Cu2+的浓度随着Na2S的加入量增大而逐渐减小(反应的微观示意图如图所示)。

①从微观角度分析反应开始时Cu2+浓度逐渐下降的原因:。
②当Na2S的加入量超过0.8g·L-1后,溶液中剩余的Cu2+浓度几乎不再随Na2S的加入而改变,可能的原因是。
-
(2) CuS炼制Cu过程中发生如下反应:
 :
: 
①炼制过程中,Cu元素的化合价发生的变化为。
②SO2会污染环境,其化学性质与CO2有相似之处,故可用(填化学式)与之反应生成CaSO3而将其除去。
-
(3) “调pH”时,若要与溶液中所含的980gH2SO4恰好完全反应,应加入的Ca(OH)2质量是多少?(写出解题过程)。
实验桌上的酒精灯被打翻时,最简单的灭火方法是( )
A . 用水扑灭
B . 用泡沫灭火器灭火
C . 用湿抹布盖灭
D . 用沙土盖灭
最近更新



