第三节 化学反应中的有关计算 知识点题库
利用四氧化三钴纳米棒作催化剂,可将汽车尾气中的CO在低温下转化为CO2。下列关于该反应的说法中,正确的是( )

A . 反应物和生成物都是化合物,该反应属于化合反应
B . 反应前后四氧化三钴纳米棒的化学性质发生了变化
C . 可有效降低汽车尾气对大气的污染
D . 反应前后氧原子数目发生了变化
下列做法可以达到预期目的是()
A . 用氮气作焊接金属的保护气
B . 寻找新的催化剂使水变成油
C . 加入净水剂(如明矾),使硬水转化成纯净水
D . 做测定空气中氧气含量的实验时,用蜡烛代替红磷
氨催化氧化是制硝酸的主要反应之一,该反应前后分子种类变化的微观示意图如图。下列说法正确的是()
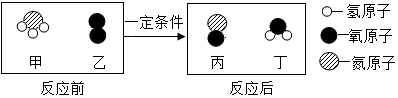
A . 生成的丙与丁的分子个数比为2:3
B . 乙的相对分子质量为32g
C . 反应前后分子的个数不变
D . 反应过程中共涉及三种氧化物
如图是甲转化为丙的微观过程,下列说法错误的是( )

A . 转化①中甲和O2反应的分子个数比为1:1
B . 丙中硫元素的化合价是+6价
C . 转化②是化合反应
D . 反应前后原子种类不变
某纯净物X在空气中燃烧,反应的化学方程式为:3X+2O2  2CO+CO2+3H2O,则X的化学式为( )
2CO+CO2+3H2O,则X的化学式为( )
 2CO+CO2+3H2O,则X的化学式为( )
2CO+CO2+3H2O,则X的化学式为( )
A . C3H6
B . CH3OH
C . HCHO
D . HCOOH
皮革作为重要的工业产品由生皮鞣制成,在这一过程中需要添加重铬酸钾。重铬酸钾在加热时分解,反应的方程式为:4K2Cr2O7  4K2Cr2O4+2X+3O2↑.
4K2Cr2O4+2X+3O2↑.
 4K2Cr2O4+2X+3O2↑.
4K2Cr2O4+2X+3O2↑.
-
(1) 写出X的化学式,K2Cr2O7的相对分子质量为;
-
(2) 这一反应能否用于实验室制取氧气?(填能或不能),原因是;
-
(3) 如下图为铬元素在元素周期表中的信息:

铬原子的核外电子数是,原子核的中子数为。
在一密闭容器中,有甲、乙、丙、丁四种物质,在一定的条件下充分反应,测得反应前后各物质质量如下表,则反应后,甲的“待测”值应为( )
| 物质 | 甲 | 乙 | 丙 | 丁 |
| 反应前质量(g) | 8 | 1 | 36 | 10 |
| 反应后质量(g) | 待测 | 20 | 0 | 31 |
A . 10
B . 8
C . 4
D . 0
化学方程式2A+B=C+2D中,A、B、C的相对分子质量依次分别为103、71、160,则D相对分子质量为。
将一定质量的铁粉加至H2SO4、MgSO4和CuSO4的混合溶液中,充分反应后过滤,得到滤液M和滤渣N.
-
(1) 写出铁和稀H2SO4反应的化学方程式:.
-
(2) 滤液M中一定含有的溶质是,滤渣N中一定含有的金属是.
-
(3) 如果滤渣N的质量恰好等于加入铁粉的质量,则混合溶液中H2SO4和CuSO4的质量比为:.
-
(1) 酸与碱之间发生中和反应,其实质是酸溶液中大量自由移动的(填离子符号)和碱溶液中大量自由移动的(填离子符号)结合成生成水分子的过程请根据以下氢氧化钠溶液与稀硫酸反应的实验,回答问题。
-
(2) 【实验1】用酚酞试液,向一锥形瓶中倾倒20g氢氧化钠溶液,滴入2滴酚酞试液,振荡,再逐滴滴入稀硫酸,边滴加边振荡,直至溶液为止,说明酸碱恰好完全反应,此时溶液中的主要溶质是。
-
(3) 【实验2】用pH计,向一锥形瓶中倾倒20g氢氧化钠溶液,再逐滴滴入稀盐酸,振荡,读出pH.当pH═,说明酸碱恰好完全反应。
-
(4) 【小结】除了用酸碱指示剂、pH试纸、pH计等外,还可用(填方法)检测中和反应是否发生。
-
(5) 【拓展】中和反应属于复分解反应,复分解反应实质是某些阴、阳离子,结合生成气体、沉淀或水。请你分析:
①硫酸铜溶液与烧碱溶液混合后实际参加反应的离子(填离子符号下同);
②碳酸钾溶液与稀硫酸混合后实际参加反应的离子是。
-
(6) 【计算】25℃时,10g 19.6%的稀硫酸恰好和60克某浓度的氢氧化钠溶液完全反应,将反应后的溶液冷却到0℃时,溶液恰好达到饱和。求:
原氢氧化钠溶液中溶质的质量分数。
-
(7) 反应后硫酸钠溶液中溶质的质量分数(不考虑水蒸发,保留小数点后一位)。
-
(8) 求0℃时,硫酸钠的溶解度(保留小数点后一位)。
一种焰火药剂的组成中含有Cu (NO3)2 , 当火药燃烧时,可产生绿色火焰,化学反应方程式为2Cu(NO3)2  2CuO+O2↑+4X↑,则X的化学式为( )
2CuO+O2↑+4X↑,则X的化学式为( )
 2CuO+O2↑+4X↑,则X的化学式为( )
2CuO+O2↑+4X↑,则X的化学式为( )
A . NO
B . NO2
C . N2O
D . N2O5
小明在实验室加热57g氯酸钾和二氧化锰的混合物一段时间后,剩余固体的质量为47.4g。小明继续加热剩余固体至完全反应,又收集到一些氧气。为了回收催化剂,进行了如图所示实验:
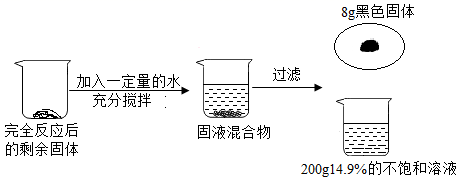
请回答下列问题:
-
(1) 实验过程中发生反应的化学方程式为;
-
(2) 第一次加热后收集到的氧气质量为;
-
(3) 列出求解两次总共参加反应的氯酸钾质量X的比例式;
-
(4) 小明两次加热过程中,消耗氯酸钾的质量比为;
-
(5) 如将所得溶液制成溶质质量分数为10%的溶液,需加入水的质量是。
填空;
-
(1) 下列燃料中,不属于化石燃料的是。(填字母符号)
A 煤 B 石油 C 乙醇 D 天然气
-
(2) 下列防锈措施不合理的是。(填字母符号)
A 擦去铝锅表面氧化膜
B 在铁制品表面涂油
C 钢管存放在干燥的地方
D 在铁管表面镀上一层不易腐蚀的金属
-
(3) 硝酸钠中的阴离子:。(填离子符号)
-
(4) 过氧化钠(Na2O2)与水反应的方程式为:
 ,则X的化学式为。
,则X的化学式为。
中国科学院某研究小组设计了一种高性能锂空气电池,其反应原理可表示为:2Li+O2  Li2O2。若要制得46g的 Li2O2 ,需要锂的质量是多少
Li2O2。若要制得46g的 Li2O2 ,需要锂的质量是多少
 Li2O2。若要制得46g的 Li2O2 ,需要锂的质量是多少
Li2O2。若要制得46g的 Li2O2 ,需要锂的质量是多少
有氯酸钾和二氧化锰混合物15g,加热使它完全反应,结果发现试管内固体物质为10.2g,试回答:可能用到的相对原子质量K:39,Cl:35.5,O:16,C:12,Mn;55
-
(1) 发生反应的化学方程式为:。
-
(2) 生成氧气的质量是:。
-
(3) 列出求解氯化钾质量(x)的比例式。
-
(4) 原混合物中氯酸钾的质量是:。
-
(5) g二氧化碳中的氧元素质量与原混合物中氯酸钾的氧元素质量相同。
实验小组用图甲所示装置探究盐酸与氢氧化钠溶液的反应,结果如图乙所示。
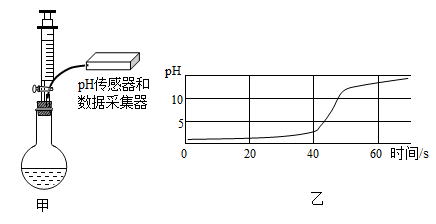
-
(1) 由图可知注射器内装的溶液是,
-
(2) 40s时,你认为烧瓶内的溶质是,若要证明你的结论,加入下列哪些物质不能达到目的(填序号)。
①铜②氧化铜③氢氧化铁④Na2CO3溶液
-
(3) 工业上用电解食盐水的方式可生产氢氧化钠,若消耗的氯化钠的质量为58.5kg,则生成的氢氧化钠的质量为。
某同学将一定量的二氧化碳通入到200g过量的氢氧化钠溶液中,反应后得到208.8g混合溶液。(反应的化学方程式是:  )
)
 )
)
-
(1) 参加反应的二氧化碳的质量是g。
-
(2) 求反应后混合溶液中碳酸钠的质量分数。(写出计算过程,计算结果精确到0.1%)
电石(CaC2)遇水发生的化学反应为: , X遇明火会剧烈燃烧,下列相关说法中不正确的是( )
, X遇明火会剧烈燃烧,下列相关说法中不正确的是( )
 , X遇明火会剧烈燃烧,下列相关说法中不正确的是( )
, X遇明火会剧烈燃烧,下列相关说法中不正确的是( )
A . X的化学式是C2H2
B . X燃烧的化学方程式为: C . X是有机化合物
D . CaC2中钙元素的质量分数为62.5%
C . X是有机化合物
D . CaC2中钙元素的质量分数为62.5%
 C . X是有机化合物
D . CaC2中钙元素的质量分数为62.5%
C . X是有机化合物
D . CaC2中钙元素的质量分数为62.5%
氢能因在使用的过程中不产生污染环境的水而被人们称为“最清洁的能源”。实验室通过金属锌和稀硫酸反应制得,原理如下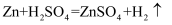 。现有6.5吨的锌理论上可产生氢气的质量是多少?
。现有6.5吨的锌理论上可产生氢气的质量是多少?
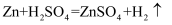 。现有6.5吨的锌理论上可产生氢气的质量是多少?
。现有6.5吨的锌理论上可产生氢气的质量是多少?
以高硫铝土矿(主要成分为Al2O3、Fe2O3 , 少量FeS2等)为原料,生产Al2O3并获得Fe3O4的部分工艺流程如下:

【查阅资料】2CaO+2SO2+O2=2CaSO4
-
(1) “焙烧”过程均中会产生SO2 , 用NaOH溶液吸收SO2的化学方程式为。
-
(2) 添加1%CaO和不添加CaO的矿粉焙烧,其硫去除率随温度变化曲线如下图所示。焙烧时,添加1%CaO的矿粉硫去除率比不添加CaO的矿粉硫去除率(填“高”或“低”),其主要原因是(用语言文字描述)。


-
(3) 工业上为了加快“碱浸”速率,可采取的措施有(写1点)。“碱浸”过程中Al2O3转化为偏铝酸钠(化学式为NaAlO2),发生反应的化学方程式是Al2O3+2NaOH=2NaAlO2+X,X的化学式为。
-
(4) “过滤”需要的玻璃仪器有烧杯、玻璃棒、。向滤液中通入过量CO2 , 铝元素转化为Al(OH)3;Al(OH)3受热分解为Al2O3 , 写出该反应的化学方程式。
-
(5) “过滤”得到的滤渣中含大量的Fe2O3、Fe2O3与FeS2混合后在缺氧条件下焙烧生成Fe3O4和SO2 , 理论上完全反应时消耗Fe2O3与FeS2的化学计量数之比为。
最近更新



