课题2 如何正确书写化学方程式 知识点题库
下列符合题意的化学方程式书写及其所属反应类型均正确的是( )
A . 过氧化氢分解制氧气 H2O2  H2↑ +O2↑ 分解反应
B . 硫酸铜溶液中加入铁粉 2Fe+3CuSO4=Fe2(SO4)3+3Cu↓置换反应
C . 氢氧化镁用于治疗胃酸过多 H2SO4+Mg(OH)2=MgSO4+2H2O复分解反应
D . 高温煅烧石灰石得到生石灰 CaCO3高温CaO+CO2↑ 分解反应
H2↑ +O2↑ 分解反应
B . 硫酸铜溶液中加入铁粉 2Fe+3CuSO4=Fe2(SO4)3+3Cu↓置换反应
C . 氢氧化镁用于治疗胃酸过多 H2SO4+Mg(OH)2=MgSO4+2H2O复分解反应
D . 高温煅烧石灰石得到生石灰 CaCO3高温CaO+CO2↑ 分解反应
 H2↑ +O2↑ 分解反应
B . 硫酸铜溶液中加入铁粉 2Fe+3CuSO4=Fe2(SO4)3+3Cu↓置换反应
C . 氢氧化镁用于治疗胃酸过多 H2SO4+Mg(OH)2=MgSO4+2H2O复分解反应
D . 高温煅烧石灰石得到生石灰 CaCO3高温CaO+CO2↑ 分解反应
H2↑ +O2↑ 分解反应
B . 硫酸铜溶液中加入铁粉 2Fe+3CuSO4=Fe2(SO4)3+3Cu↓置换反应
C . 氢氧化镁用于治疗胃酸过多 H2SO4+Mg(OH)2=MgSO4+2H2O复分解反应
D . 高温煅烧石灰石得到生石灰 CaCO3高温CaO+CO2↑ 分解反应
完成下列化学方程式.
-
(1) CO2+3H2
 CH4O+
CH4O+
-
(2) 2KNO3+S+3C═K2S+3CO2↑+↑
-
(3) Al+O2
 Al2O3
Al2O3
-
(4) Fe2O3+CO═ Fe+CO2
-
(5) 白加黑制氧气:
-
(6) 碳还原氧化铜:.
下列化学方程式书写不正确的是( )
A . 4Fe+3O2  2Fe2O3
B . CaCO3
2Fe2O3
B . CaCO3  CO2↑+CaO
C . 4P+5O2
CO2↑+CaO
C . 4P+5O2  2P2O5
D . 2NaOH+CuSO4═Cu(OH)2↓+Na2SO4
2P2O5
D . 2NaOH+CuSO4═Cu(OH)2↓+Na2SO4
 2Fe2O3
B . CaCO3
2Fe2O3
B . CaCO3  CO2↑+CaO
C . 4P+5O2
CO2↑+CaO
C . 4P+5O2  2P2O5
D . 2NaOH+CuSO4═Cu(OH)2↓+Na2SO4
2P2O5
D . 2NaOH+CuSO4═Cu(OH)2↓+Na2SO4
现欲探究一固体混合物A的成分,已知其中可能含有CuSO4、CaCO3、NH4NO3、Cu四种物质中的两种或多种。按下图所示进行实验,出现的现象如图中所述(设过程中所有发生的反应都恰好完全反应)。

试根据实验过程和出现的现象做出判断,填写以下空白:
-
(1) 固体C的化学式为。
-
(2) 在混合物A中,共含有种物质。
-
(3) 气体E的气味是。
-
(4) 溶液G中存在的金属阳离子为(写离子符号)。
-
(5) 写出实验过程②中生成气体E所发生反应的化学方程式:。
A﹣H是学过的一些物质,其中A是暗紫色固体,B是人体生命活动离不开的气体,C是黑色的固体粉末。它们之间有如图所示的转化关系:

回答下列问题:
-
(1) 写出下列物质的名称或符号:B ;G 。
-
(2) 写出反应①的表达式:。
-
(3) 若反应②的实验现象为:发出蓝紫色的火焰,生成刺激性气味的气体F,则该反应的表达式是。
-
(4) C在反应③中的作用是。
人教版新课标化学教材九年级上册“分解过氧化氢制氧气的反应中二氧化锰的催化作用”,以及“寻找新的催化剂研究性实验,引起了化学探究小组的兴趣。
(提出问题)氧化铁能否作过氧化氢溶液分解的催化剂?如果能,其催化效果如何?
(实验探究)
实验步骤 | 实验现象 |
I.分别量取5mL5%过氧化氢溶液放入A、B两支试管中,向A试管中加入ag氧化铁粉末,并分别在A、B两支试管中插入带火星木条,观察现象。 | A试管中产生气泡,带火星木条复燃,B试管中无明显现象。 |
II.待A试管中没有现象发生时,重新加入过氧化氢溶液,并把带火星的木条伸入试管,如此反复多次试验,观察现象。 | 试管中均产生气泡,带火星木条均复燃 |
III.将实验II中的剩余物小心过滤,并将所得滤渣进行洗涤、干燥、称量,所得固体质量仍为ag。 |
|
IV.分别量取5mL5%过氧化氢溶液放入C、D两支试管中,向C试管中加入ag氧化铁粉末,向D试管中加入__________g二氧化锰粉末,观察现象。 | D试管中产生气泡的速率比C试管快 |
(实验结论)
-
(1) A中产生的气体是;
-
(2) 实验Ⅱ、Ⅲ证明:氧化铁的和在反应前后均没有发生变化,可以作过氧化氢分解的催化剂;
-
(3) 写出氧化铁催化过氧化氢分解的文字或者符号表达式。
-
(4) (实验评价)
实验设计IV的目的是;此步骤中二氧化锰的质量应该是g
-
(5) 通过实验IV,你可以得到的结论是。
如图中A,B,C,D,E,F是初中化学常见的物质。其中A是黑色的固体, C是产生温室效应的主要气体。“  ”表示两端的物质能发生反应,“→”表示一种物质可以转化为另一种物质(部分反应物、生成物和反应条件已省略)。请回答下列问题:
”表示两端的物质能发生反应,“→”表示一种物质可以转化为另一种物质(部分反应物、生成物和反应条件已省略)。请回答下列问题:

-
(1) 若A与一种黑色物质反应生成C,有红色物质生成,A→C反应的化学方程式是。该反应的基本反应类型是。
-
(2) 写出C物质的一种用途 。
-
(3) 写出E→F任意一个正确的化学方程式。
在活动中,同学们认识了神奇的干冰。
-
(1) 干冰可做食品制冷剂,利用了干冰的性质是。
-
(2) 将一小块干冰放入澄清的石灰水中,观察到干冰上下跳动,石灰水变浑浊,发生反应的化学方程式为。
如图所示,A,B,C,D,E分别是初中化学常见的不同类别的物质,X是人体内含量最高的物质,A用于配制波尔多液。(用“一”表示两种物质能发生反应,用→”
表示一种物质能转他为另一种物质,用“←→”表示两种物质能互相转化,部分反应物和生成物及反应条件已略去,图中部分反应需要在溶液中进行,物质是溶液的只考虑溶质)

-
(1) 写出D,E物质的化学式:④D.;②E.;
-
(2) A与B反应的化学方程式为:
-
(3) 氧化铁与过量D反应的实验现象为
-
(4) 在图中补充通过化合反应实现的一个转化关系和一个反应关系。
工业烟气脱硫中采用“双碱法”脱硫的工业流程如下:

-
(1) 吸收塔中,用NaOH溶液吸收SO2生成亚硫酸钠(Na2SO3)和水,则Na2SO3中硫元素的化合价为。
-
(2) 沉淀室中发生了复分解反应,请写出此反应的化学方程式。
写出下列化学方程式。
a.发出耀眼的白光;
b.产生大量白烟;
c.酒精的燃烧。
实验室常用下列装置制取气体,请根据所学知识回答。
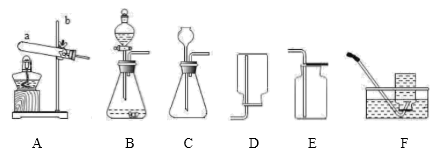
-
(1) 写出图中仪器名称:a;b。
-
(2) 实验室用A装置制取氧气。
I.反应的化学方程式为,搭建A装置时,酒精灯应在固定仪器a之(选填“前”或“后”)放置。
II.从反应后的剩余固体中回收得到二氧化锰的操作步骤顺序是。(请填写编号)
①洗涤 ②过滤 ③烘干 ④溶解
-
(3) 实验室在常温下用块状电石与水反应制取乙炔气体,该反应必须严格控制加水速度,以免引起发生装置炸裂。上图中最适合制取乙炔气体的发生装置是(填装置编号)。
-
(4) 选用F装置收集较纯净氧气的适宜时刻是。也可选择E装置收集氧气,依据是,证明氧气已集满的方法为。
-
(5) 选用C装置,将一定量的双氧水和二氧化锰混合,充分反应,测得反应的总质量(m)与反应时间(t)的数据如下表所示:
反应时间t/s




总质量m/g
50
49.0
48.1
47.3
46.8
46.8
根据题目要求,回答下列问题:
I.双氧水和二氧化锰完全反应生成氧气的质量是;
II.分解的过氧化氢的物质的量是多少摩尔?(列式计算)。
我国科学家采用一种新型复合催化剂,将煤气化产生的合成气直接转化为乙烯、丙烯等低碳烯烃。这项成果的微观示意图如图。下列说法不正确的是( )

A . 该反应可将无机物转化为有机物
B . 甲、丙、丁都是氧化物
C . 参加反应的甲、乙的质量比为28:1
D . 该反应的化学方程式为4CO+2H2  C2H4+2CO2
C2H4+2CO2
 C2H4+2CO2
C2H4+2CO2
-
(1) 在牙膏中,常用轻质碳酸钙粉末作摩擦剂.人们通常用下列方法生产轻质碳酸钙: ①将石灰石[主要成分为碳酸钙]煅烧制得氧化钙,②再将氧化钙加水制成石灰乳[主要成分是Ca(OH)2],③将净化后的石灰乳与二氧化碳作用得到碳酸钙。其中第①步中发生反应的化学方程式是,属于反应;第③步反应的化学方程式是,第②步属于反应。
-
(2) 燃料的燃烧在人类社会的发展过程中起着相当重要的作用。从环境保护的角度考虑,在煤气、沼气[即甲烷(CH4)]和氢气中,首选的燃料是,写出该气体燃烧的化学方程式;煤气的主要成分是CO,其燃烧的化学方程式为。
黑火药的原料有木炭、硫磺、硝酸钾等。
-
(1) 化学知识“谜语化”可以增添学习化学的乐趣并能增强记忆。谜语:“闻有刺鼻味,含量平均分。酸雨由它造,追捕无影踪。”适合作为谜底的物质即是燃放烟花爆竹时产生气体(写化学式)
-
(2) 为了使焰火明亮,常常在火药中加入镁粉。镁是一种色固体,镁可以在氧气中燃烧也可在氮气及二氧化碳中燃烧。镁粉在二氧化碳中燃烧生成一种黑色单质和一种氧化物,试写出该化学方程式为。
-
(3) 现在很多城市禁止燃放烟花爆竹,下列原因可能的是
A 燃放烟花爆竹造成空气污染
B 燃放烟花爆竹造成噪声污染
C 燃放烟花爆竹容易引发火灾等安全事故
化学就在我们身边
-
(1) 用稀硫酸除铁锈的原理用化学方程式表示为 ;
-
(2) 酒精燃烧的化学方程式为 ;
-
(3) 草木灰的主要成分是 (填化学式)。
下列反应的化学方程式书写正确的是( )
A . 高炉炼铁:  B . 盐酸除铁锈:
B . 盐酸除铁锈: 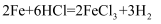 C . 小苏打治疗胃酸过多:
C . 小苏打治疗胃酸过多:  D . 铝制品耐腐蚀:
D . 铝制品耐腐蚀: 
 B . 盐酸除铁锈:
B . 盐酸除铁锈: 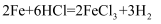 C . 小苏打治疗胃酸过多:
C . 小苏打治疗胃酸过多:  D . 铝制品耐腐蚀:
D . 铝制品耐腐蚀: 
下列描述涉及的化学方程式正确的是( )
A . 铁丝在氧气中燃烧:3Fe+2O2 Fe3O4
B . 实验室加热高锰酸钾制取氧气:KMnO4
Fe3O4
B . 实验室加热高锰酸钾制取氧气:KMnO4 K2MnO4+MnO2+O2↑
C . 酒精作燃料:C2H5OH+3O2
K2MnO4+MnO2+O2↑
C . 酒精作燃料:C2H5OH+3O2 2H2O+CO2
D . 高温煅烧石灰石制取生石灰:CaCO3=CaO+CO2↑
2H2O+CO2
D . 高温煅烧石灰石制取生石灰:CaCO3=CaO+CO2↑
 Fe3O4
B . 实验室加热高锰酸钾制取氧气:KMnO4
Fe3O4
B . 实验室加热高锰酸钾制取氧气:KMnO4 K2MnO4+MnO2+O2↑
C . 酒精作燃料:C2H5OH+3O2
K2MnO4+MnO2+O2↑
C . 酒精作燃料:C2H5OH+3O2 2H2O+CO2
D . 高温煅烧石灰石制取生石灰:CaCO3=CaO+CO2↑
2H2O+CO2
D . 高温煅烧石灰石制取生石灰:CaCO3=CaO+CO2↑
我国是世界上最早使用“湿法炼铜”的国家。“湿法炼铜”的原理是硫酸铜溶液与铁反应,该反应的化学方程式为。
如图为初中阶段常见的制取气体的发生装置,请据图回答以下问题。

-
(1) 请写出仪器a的名称。
-
(2) 请选择一种装置制取气体。【温馨提示:写出①检查装置气密性的方法②实验原理(用化学方程式表示)③验满方法。】
-
(3) 若上述实验过程中产生气体的速率较慢,你的解决方法是什么?
最近更新



