第一节 化学实验基本方法 知识点题库
下列实验操作中正确的是( )
A . 蒸馏原理适用于分离互不相溶的液体混合物
B . 蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶支管口处
C . 蒸馏操作时,冷凝管中冷却水应该是上口进下口出
D . 蒸馏操作时,沸点高的物质先被蒸出来
除去MgO中的Al2O3可选用的试剂是( )
A . NaOH溶液
B . 硝酸
C . 浓硫酸
D . 稀盐酸
食品干燥剂应无毒、无味、无腐蚀性及环境友好。下列说法错误的是( )
A . 硅胶可用作食品干燥剂
B . 烧碱固体可用作食品干燥剂
C . P2O5不可用作食品干燥剂
D . 具有吸水性的植物纤维可用作食品干燥剂
下面哪个图是以乙酸、浓硫酸和乙醇为原料合成乙酸乙酯的最佳装置是( )
A .  B .
B . 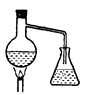 C .
C . 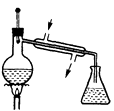 D .
D . 
 B .
B .  C .
C .  D .
D . 
下列对于NaHSO4的分类中错误的是:( )
A . NaHSO4是盐
B . NaHSO4是酸式盐
C . NaHSO4是钠盐
D . NaHSO4是酸
为除去括号内的杂质,所选用的试剂或方法错误的是( )
A . Na2CO3固体(NaHCO3):加热
B . FeCl2溶液(FeCl3):加入足量铜粉,过滤
C . Na2O2粉末(Na2O):将混合物在氧气中加热
D . NaHCO3溶液(Na2CO3):通入过量的CO2气体
某化学兴趣小组为探究Fe2+、Fe3+的性质进行了一系列试验。请回答下列问题:
-
(1) 分别取一定量氯化铁、氯化亚铁固体,均配制成0.1mol·L-1的溶液。在FeCl2溶液中需加入少量铁屑, 其目的是。
-
(2) 甲组同学取2mLFeCl2溶液,加入几滴氯水,再加入1滴KSCN溶液,溶液变红,说明氯水可将Fe2+氧 化。FeCl2溶液与氯水反应的离子方程式为。
-
(3) 乙组同学认为甲组同学的实验不够严谨,请你改进一下,并简述实验方案:(可选用药品:01mol• L-1 FeCl2溶液、氯水、KSCN溶液、煤油)。
-
(4) 丙组同学向盛有H2O2溶液的试管中加入几滴酸化的FeCl2溶液,溶液变成棕黄色,发生反应的离子方程式为。
-
(5) 丁组同学取10mL 0.1mol• L-1 KI溶液,加入6mL0.1mol• L-1 FeCl3溶液,充分反应。取1mL反应后溶液加入1mLCCl4充分振荡、静置,观察到的现象是。
-
(6) 四个小组的同学通过实验探究,得出结论:Fe2+有性;Fe3+、Cl2、I2的氧化性由大到小的顺序是。
下列仪器名称错误的是( )
A . 量筒  B . 圆底烧瓶
B . 圆底烧瓶 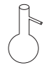 C . 容量瓶
C . 容量瓶 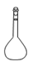 D . 分液漏斗
D . 分液漏斗 
 C . 容量瓶
C . 容量瓶
下列有关除杂质(括号内物质为杂质)的试剂及分离方法中,正确的是( )
A . CH4(C2H4):酸性高锰酸钾溶液,洗气
B . 乙酸乙酯(乙酸): NaOH溶液,分液
C . 苯(Br2): NaOH溶液,分液
D . 乙酸(水):生石灰,蒸馏
-
(1) Ⅰ.实验室常用MnO2 与浓盐酸反应制备Cl2(装置如图所示)。
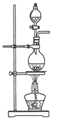
制备实验开始时,先检査装置气密性,接下来的操作依次是:(填序号)。
①往烧瓶中加入MnO2粉末 ②加热 ③往烧瓶中加入浓盐酸
-
(2) 写出圆底烧瓶中发生反应的离子方程式。
-
(3) 制备反应会因盐酸浓度下降而停止,为测定反应残余液中盐酸的浓度。甲同学提出下列具体方案。请你从下列实验方案中选择合理的实验方法(填编号)。
a.将Cl-转化为AgCl沉淀,过滤,洗涤,干燥,称量沉淀的质量
b.与足量NaHCO3固体反应,将反应后气体直接用碱石灰吸收,测定生成的气体的质量
c.与足量锌反应,测量生成气体标准状况下的体积
-
(4) Ⅱ. 为测定某亚硫酸钠样品纯度,研究小组利用如下装置(装置图中夹持仪器已省略)进行实验。反应完全后,取C中溶液,加入过量BaCl2溶液,过滤、操作①、干燥、称量,利用所得数据计算样品纯度。请回答:
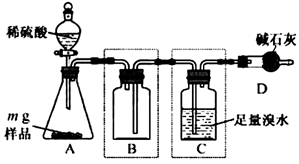
操作①的名称是。
-
(5) 装置B的作用是。
-
(6) 上述实验测得的样品纯度比实际偏低,为提高测定结果的准确度,针对装置可采取的改进措施是(写两种)。
氯化亚铜(CuCl)是一种重要的化工产品。它不溶于H2SO4、HNO3 和醇,微溶于水,可溶于浓盐酸和氨水,在潮湿空气中易水解氧化成绿色的碱式氯化铜[Cu2(OH)4-nCln],n随着环境酸度的改变而改变。以海绵铜(主要成分是Cu和少量CuO)为原料,采用硝酸铵氧化分解技术生产CuCl的工艺过程如图:
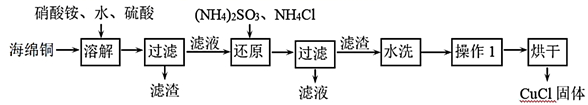
-
(1) 还原过程中主要反应的离子方程式为。
-
(2) 实验室为了加快过滤速度,往往采用抽滤的操作(如图)。仪器A的名称,有关抽滤,下列说法正确的是

A.抽滤完毕,应先拆下连接抽气泵和吸滤瓶的橡胶管,再关闭水龙头,最后将滤液从吸滤瓶上口倒出
B.在布氏漏斗中放入滤纸后,直接用倾析法转移溶液和沉淀,再打开水龙头抽滤
C.在抽滤装置中洗涤晶体时,为减少晶体溶解损失,应使洗涤剂快速通过滤纸
D.减压过滤不宜用于过滤胶状或颗粒太小的沉淀
-
(3) 操作1为马上再洗涤,然后在真空干燥机内于70℃干燥2h,冷却、密封包装。其中最合理的洗涤试剂
A.浓盐酸 B.浓氨水 C.无水乙醇 D.水+乙醇
真空干燥的原因是。
-
(4) 随着pH减小,Cu2(OH)4-nCln中铜的质量分数__________A . 增大 B . 不变 C . 减小 D . 不能确定
镍及其化合物用途广泛。某矿渣的主要成分是NiFe2O4(铁酸镍)、NiO、FeO、CaO、SiO2等,以下是从该矿渣中回收NiSO4的工艺路线:

已知:(NH4)2SO4在350℃以上会分解生成NH3和H2SO4。
-
(1) 焙烧过程中NiFe2O4发生反应的化学方程式是。
-
(2) “浸泡”过程中Fe2(SO4)3生成FeO(OH)的离子方程式为,“浸渣”的成分除Fe2O3、FeO(OH)、Fe(OH)3外还含有、(填化学式)。
-
(3) “浸泡”过程中温度低于95℃,可能导致的主要问题有(写出一点即可)。
-
(4) “浸出液”中c(Ca2+)=1.0×10-3mol·L-1 , 当除钙率达到99%时,溶液中c(F-)=mol·L-1。[已知Ksp(CaF2)=4.0×10-11]
-
(5) 本工艺中,萃取剂与溶液的体积比(
 )对溶液中Ni2+、Fe2+的萃取率影响如图所示,
)对溶液中Ni2+、Fe2+的萃取率影响如图所示,  的最佳取值是。
的最佳取值是。 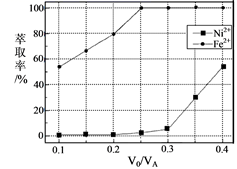
蒸馏时须用到的仪器是( )
A .  B .
B .  C .
C .  D .
D . 
 B .
B .  C .
C .  D .
D . 
某同学设计了如下实验方法分离KNO3和Ba(NO3)2两种固体混合物并测定其含量:
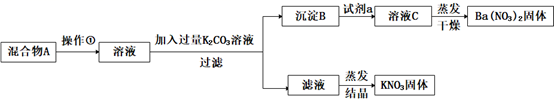
-
(1) 操作①的名称是,试剂a是(填化学式)。
-
(2) 加入K2CO3溶液所发生反应的离子方程式是。
-
(3) 按此实验方案分离得到的KNO3 , 经分析含有杂质K2CO3 , 除去K2CO3的操作为
-
(4) 过滤后洗涤沉淀B的实验操作为。
-
(5) 验前称量混合物A的质量为m g,称量经洗涤干燥后的沉淀B的质量为w g,则混合物中Ba(NO3)2质量分数为。
碳酸镧[  ,
,  ]可用于治疗肾病患者的高磷酸盐血症。其制备反应的原理为:
]可用于治疗肾病患者的高磷酸盐血症。其制备反应的原理为:  。利用下列装置在实验室中模拟制备
。利用下列装置在实验室中模拟制备  。
。
 ,
,  ]可用于治疗肾病患者的高磷酸盐血症。其制备反应的原理为:
]可用于治疗肾病患者的高磷酸盐血症。其制备反应的原理为:  。利用下列装置在实验室中模拟制备
。利用下列装置在实验室中模拟制备  。
。 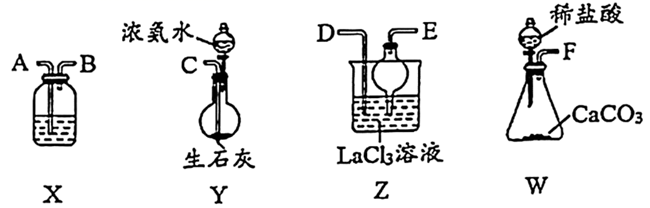
完成下列填空:
-
(1) Y中盛放浓氨水的仪器名称为。
-
(2) 制备
 实验流程中装置接口的连接顺序为F→→→;C→。
实验流程中装置接口的连接顺序为F→→→;C→。
-
(3) Y中发生反应的化学方程式为。
-
(4) X中盛放的试剂是。
-
(5) Z中应先通
 ,后通入过量的
,后通入过量的  ,原因是。
,原因是。
-
(6)
 质量分数的测定(杂质不与盐酸反应):准确称取10.000g产品试样,溶于足量稀盐酸中,将生成的
质量分数的测定(杂质不与盐酸反应):准确称取10.000g产品试样,溶于足量稀盐酸中,将生成的  全部通入过量的
全部通入过量的 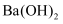 溶液中,得到沉淀8.865g。
溶液中,得到沉淀8.865g。  的质量分数为。
的质量分数为。
山西南部中条山地区采矿炼铜历史悠久。黄铜矿[主要成分是 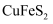 ,含少量氯磷灰石
,含少量氯磷灰石  等]为原料的火法炼铜主要流程如下:
等]为原料的火法炼铜主要流程如下:
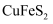 ,含少量氯磷灰石
,含少量氯磷灰石  等]为原料的火法炼铜主要流程如下:
等]为原料的火法炼铜主要流程如下: 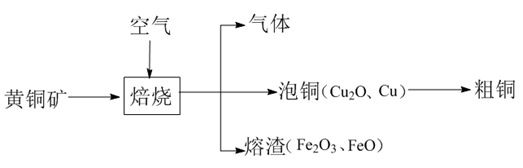
已知:氯磷灰石高温下易被氧化为  。某化学兴趣小组以黄铜矿为原料进行如下实验探究。请根据题意回答相关问题:
。某化学兴趣小组以黄铜矿为原料进行如下实验探究。请根据题意回答相关问题:
-
(1) 燃烧碘量法测定黄铜矿中硫元素的含量。将
 矿样与足量
矿样与足量  混合,以氮气为载气,在1250℃左右高温炉中加热,将产生的
混合,以氮气为载气,在1250℃左右高温炉中加热,将产生的  气体用含淀粉及碘化钾的稀硫酸溶液吸收,同时连续用
气体用含淀粉及碘化钾的稀硫酸溶液吸收,同时连续用 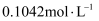 的
的 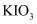 标准溶液缓慢滴定。装置如图所示(
标准溶液缓慢滴定。装置如图所示( 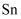 的
的 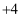 价化合物比
价化合物比 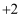 价稳定)。
价稳定)。 
①酸性高锰酸钾溶液的作用是。
②滴定过程中涉及反应有:
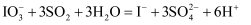 、(写离子方程式),终点现象为。
、(写离子方程式),终点现象为。③滴定至终点时,消耗标准液体积
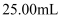 ,矿样中硫元素的质量百分含量为(结果保留两位有效数字),若
,矿样中硫元素的质量百分含量为(结果保留两位有效数字),若  不通过
不通过 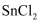 ,则测定结果会(填“偏高”、“偏低”、“不影响”)。
,则测定结果会(填“偏高”、“偏低”、“不影响”)。 -
(2) 利用如下装置制取粗铜。
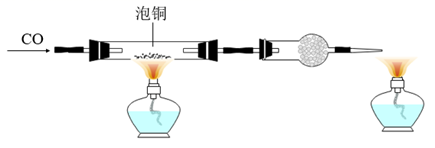
实验开始时的操作依次为(填写序号)。
①检查装置的气密性 ②通入
 气体 ③收集
气体 ③收集  并检验其纯度 ④组装仪器 ⑤点燃酒精灯 ⑥加装药品
并检验其纯度 ④组装仪器 ⑤点燃酒精灯 ⑥加装药品 -
(3) 由熔渣制得绿矾
 的流程如下(已知
的流程如下(已知  难溶于水)。
难溶于水)。 
步骤①溶解熔渣选用的试剂最好是,步骤②加入
 的目的是将
的目的是将  还原(硫元素被氧化为
还原(硫元素被氧化为  ),发生反应的离子方程式为,步骤③的系列操作为、(用乙醇)洗涤、干燥。
),发生反应的离子方程式为,步骤③的系列操作为、(用乙醇)洗涤、干燥。
合成环己酮缩乙二醇的原理为 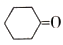 + HOCH2CH2OH
+ HOCH2CH2OH 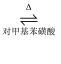
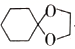 +H2O。在反应体系中加入适量苯,利用如图装置(加热及夹持装置省略)可提高环已酮缩乙二醇产率。下列说法错误的是( )
+H2O。在反应体系中加入适量苯,利用如图装置(加热及夹持装置省略)可提高环已酮缩乙二醇产率。下列说法错误的是( )
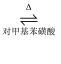
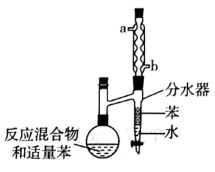
A . b是冷却水的进水口
B . 对甲基苯磺酸可能起催化作用
C . 苯可将反应产生的水及时带出
D . 当苯即将回流烧瓶中时,必须将分水器中的水和苯放出
下列实验能达到预期目的的是( )
A . 用乙醇和浓硫酸除去乙酸乙酯中的少量乙酸
B . 用食醋和澄清石灰水验证蛋壳中含碳酸盐
C . 用蒸馏水鉴别乙醇、乙醛和四氯化碳
D . 用分液漏斗分离溴和苯
下列说法错误的是( )
A . 可利用二氧化碳制造全降解塑料
B . 钠和钾的合金在常温下是液体
C . 氢氧化钠溶液保存在带玻璃塞的试剂瓶中
D . 硫酸亚铁可用于生产防治缺铁性贫血的药剂
利用烟道气中的SO2生产 Na2S2O5(焦亚硫酸钠)的工艺如图,已知:NaHSO3过饱和溶液经结晶 脱水制得 Na2S2O5。下列说法不正确的是( )
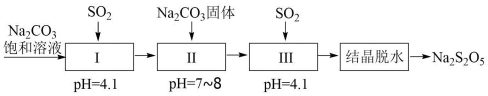
A . 步骤Ⅰ中为 NaHSO3溶液
B . 步骤Ⅱ的目的是使 NaHSO3转化为 Na2S2O5 , 可用 NaOH溶液代替 Na2CO3固体
C . 工艺中加入 Na2CO3固体、并再次充入 SO2的目的是得到 NaHSO3过饱和溶液
D . 在测定某葡萄酒中 Na2S2O5残留量时,可用一定浓度的碘标准液进行滴定
最近更新



