第一节 化学实验基本方法 知识点题库


已知:①浸出液中含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见表:(金属离子浓度为:0.01mol/L)
沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
③CoCl2•6H2O熔点为86℃,加热至110~120℃时,失去结晶水生成无水氯化钴.
-
(1) 写出浸出过程中Co2O3发生反应的离子方程式.
-
(2) 写出NaClO3发生反应的主要离子方程式;若不慎向“浸出液”中加过量NaClO3时,可能会生成有毒气体,写出生成该有毒气体的离子方程式.
-
(3) “加Na2CO3调pH至a”,过滤所得到的两种沉淀的化学式为.
-
(4) 制得的CoCl2•6H2O在烘干时需减压烘干的原因是.
-
(5) 萃取剂对金属离子的萃取率与pH的关系如图2.向“滤液”中加入萃取剂的目的是;其使用的最佳pH范围是.
A.2.0~2.5 B.3.0~3.5 C.4.0~4.5 D.5.0~5.5
-
(6) 为测定粗产品中CoCl2•6H2O含量,称取一定质量的粗产品溶于水,加入足量AgNO3溶液,过滤、洗涤,将沉淀烘干后称其质量.通过计算发现粗产品中CoCl2•6H2O的质量分数大于100%,其原因可能是.(答一条即可)
 点燃酒精灯
B . 不慎将浓碱溶液沾到皮肤上,要立即用大量水冲洗,然后涂上2%~5%的硼酸溶液
C .
点燃酒精灯
B . 不慎将浓碱溶液沾到皮肤上,要立即用大量水冲洗,然后涂上2%~5%的硼酸溶液
C . 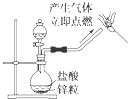 制备氢气并检验H2的可燃性
D .
制备氢气并检验H2的可燃性
D . 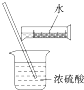 配制硫酸溶液
配制硫酸溶液
已知298℃时,Ksp[Fe(OH)3]=4.0×10-38 , Ksp[Cu(OH)2]=2.2×10-20 , Ksp[Mn(OH)2]=1.9×10-13 , 当离子浓度小于1×10-5认为离子沉淀完全。
回答下列问题:
-
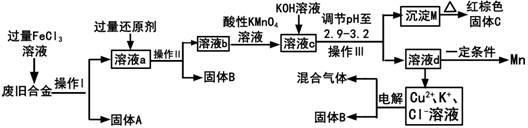
(1) 操作I、lI、III为,固体A是(填化学式)。
-
(2) 加入过量FeCl3溶液过程中与较不活泼的金属反应的化学方程式。
-
(3) 调节pH至2.9~3.2的目的。
-
(4) ①向溶液b中加入酸性KMnO4溶液发生反应的离子方程式为。
②若将溶液b配制成250ml溶液,用滴定管取配制后的溶液25.00m1;再用a mol/L KMnO4溶液滴定,恰好反应时消耗KMnO4溶液VmL,则流程图中所得红棕色固体C的质量为g(用含a、v的代数式表示)
-
(5) 常温下,若溶液c中所含的金属阳离子浓度相等,向溶液c中逐滴加入KOH溶液,最后沉淀的金属离子为(填金属阳离子)。
-
(6) 用惰性电极电解(Cu2+、K+、Cl-溶液)一段时间后,阴、阳两极均产生标准状况下的气体6.72L,阴极析出固体3.2g,则原溶液Cl-的物质的量为。

请回答:
-
(1) 步骤I加入乙醇的目的是。
-
(2) 验证步骤II中反应已完全的操作是。
-
(3) 步骤III加入60 mL热饱和食盐水,充分搅拌,冷却后即有脂肪酸钠固体析出,若直接用冷的饱和食盐水,则所得皂基容易吸水糊化,使用饱和食盐水的目的是;必须使用热饱和食盐水的原因是。
-
(4) 向皂化尾液中滴入新制Cu(OH)2 , 振荡,溶液呈绛蓝色,该反应的化学方程式为。
-
(5) ①查阅资料,一种从皂化尾液中分离提纯甘油(丙三醇)的工艺:先向皂化尾液中加入3倍体积的正丁醇;随着正丁醇的加入,皂化尾液中的盐分会结晶析出,液相分为上层有机相和下层水相;上层有机相经过精馏(一种蒸馏方法),回收正丁醇,同时除去水,并得到高纯度甘油;下层水相过滤,滤液回流至萃取塔内再处理,结晶的氯化钠洗涤回收。
下列说法正确的是。
A.正丁醇与水可以任意比例互溶 B.氯化钠在正丁醇中溶解度小
C.分层后甘油全在有机相,水相中没有残留 D.正丁醇的沸点低于甘油
②小组采用下图装置模拟分离提纯甘油(夹持装置和加热装置已略去,毛细管的作用是防止暴沸)。

请选择正确的操作并按序排列:装配好蒸馏装置→检查装置的气密性→向蒸馏烧瓶加入适量皂化尾液→打开真空泵→接通冷凝水→给蒸馏烧瓶加热→→→→→拆除装置。
a.收集甘油,至温度计读数开始增大时;b.收集正丁醇与水的混合物,至温度计读数开始增大时;c.等体系内外压力平衡后关闭真空泵;d.无馏出物后,关闭冷凝水;e.移去热源。

回答下列问题:
-
(1) 若想提高钼精矿焙烧的速率,可采取的措施有。 任写一种即可)
-
(2) 如果在空气中焙烧1mol MoS2时,S 转移12mol 电子,则发生反应的化学方程式为;焙烧产生的尾气对环境的主要危害是。
-
(3) 钼精矿中 MoS2含量的测定:取钼精矿 160g( 假设杂质不与空气反应),经在空气中焙烧 若在焙烧过程中产生的尾气用过量的浓氨水吸收,则需要质量分数为 40%,密度为 0.85g • cm-3的氨水 150mL。(假设各步的转化率均为 100%) , 则 MoS2 的百分含量为。(已知MoS2的相对分子质量为160)。
-
(4) 操作 3 硫元素被氧化为最高价,发生反应的离子方程式为。
-
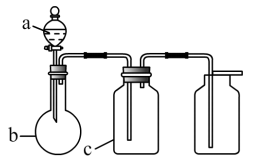
(5) 用镍、钼作电极电解浓 NaOH溶液制备钼酸钠( Na2MoO4)的装置如图 1 所示。b电极上的电极反应式为。

-
(6) 某温度下,BaMoO4在水中的沉淀溶解平衡曲线如图 2 所示,该温度下BaMoO4的Ksp的值为。
编号 | 气体 | a | b | c |
A | NH3 | 浓氨水 | 固体氢氧化钠 | 浓硫酸 |
B | CO2 | 盐酸 | 碳酸钙 | 饱和NaHCO3溶液 |
C | Cl2 | 浓盐酸 | 二氧化锰 | 浓硫酸 |
D | NO2 | 浓硝酸 | 铜屑 | NaOH溶液 |
实验目的 | 实验操作 | |
A | 除去乙烷中的乙烯 | 将混合气体通入酸性高锰酸钾溶液 |
B | 除去乙醇中的水 | 加入生石灰,蒸馏 |
C | 鉴别苯和环己烷 | 加入溴水振荡,静置后观察分层及颜色差异 |
D | 分离苯和溴苯 | 加水后分液 |
①烧杯②100mL量筒③托盘天平(带砝码)④玻璃棒⑤胶头滴管
-
(1) 配制时,还缺少的玻璃仪器是。应称量的NaOH的质量是g。
-
(2) 使用容量瓶前必须进行的一步操作是。
-
(3) 下列图片表示配制溶液的步骤,请写出正确的操作顺序是:(用数字表示,每个数字只能用一次)

-
(4) 若其它操作均正确,以下操作会引起所配溶液浓度偏大的是____(填写字母)。
A.在滤纸上称量NaOH
A . 定容时俯视刻度线 B . 转移前,容量瓶中有少量蒸馏水 C . NaOH溶解后,未冷却就立即转移到容量瓶 D . 定容摇匀后,发现液面低于刻度线,再加水至刻度线



