第二节 化学计量在实验中的应用 知识点题库
下列说法正确的是( )
A . 1molO2的质量是32g/mol
B . H2的摩尔质量是2g
C . 1molH+的质量是1g
D . 对原子而言,摩尔质量就是原子量
下列溶液中Cl﹣的物质的量浓度和Cl﹣的物质的量与50mL 1mol•L﹣1的AlCl3溶液中Cl﹣物质的量浓度和Cl﹣的物质的量都相等的是( )
A . 75 mL 2 mol•L﹣1 的NH4Cl
B . 150 mL 1 mol•L﹣1 的NaCl
C . 50 mL 1.5 mol•L﹣1 的CaCl2
D . 50 mL 3 mol•L﹣1 的KClO3
已知3.2g某气体的分子数目为3.01×1022 , 由此可推知该气体的摩尔质量是( )
A . 64 g
B . 32 g•mol﹣1
C . 32 g
D . 64 g•mol﹣1
发射卫星的火箭推进器中大多使用燃料偏二甲肼,其化学式C2H8N2 . 计算:
-
(1) 偏二甲肼的摩尔质量是;480g偏二甲肼的物质的量为.
-
(2) 偏二甲肼中碳原子与氮原子的个数之比是,其物质的量之比是;1mol偏二甲肼中含有的氢原子数目是.
100ml0.25mol•L﹣1 AlCl3溶液中,Cl﹣的物质的量浓度为 mol•L﹣1;若将上述溶液加水稀释到500ml,Cl﹣的物质的量浓度为 mol•L﹣1 .
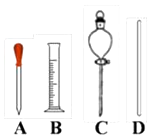
①如图Ⅰ表示10mL量筒中液面的位置.A与B,B与C刻度间相差1mL,如果刻度A为6,量筒中液体的体积是mL.
②图Ⅱ表示50mL滴定管中液面的位置.如果液面处的 读数是a,则滴定管中液体的体积(填代号).
A.是a mL B.一定大于a mL
C.是(50﹣a) mL D.一定大于(50﹣a) mL.

等质量的下列物质所含分子数最多的是( )
A . NH3
B . HCl
C . Cl2
D . H2SO4
在标准状况下,将wgA气体(摩尔质量为Mg/mol)溶于1L水中,所得溶液密度为dg/mL,则此溶液的物质的量浓度为( )mol/L.
A .  B .
B . 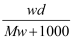 C .
C . 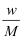 D .
D . 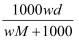
 B .
B . 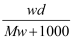 C .
C . 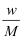 D .
D . 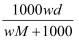
在相同的温度和压强下,4个相同体积的密闭容器中分 别装有4种气体.则4个容器中气体的质量最大是( )
A . CO2 ,
B . O2
C . N2
D . CH4
现将200mL0.01mol/LNaOH与50mL某浓度的Ca (OH)2溶液混合(混合后体积变化忽略不计),所得溶液中OH﹣的物质的量浓度是0.016mol/L,则Ca(OH)2溶液的物质的量浓度是mol/L.
实验室用NaOH固体配制250mL 1.0/L的NaOH溶液填空并请回答下列问题:
-
(1) 配制时必须的玻璃仪器有:烧杯、玻璃棒、量筒、、.
-
(2) 用托盘天平秤取NaOH固体.
-
(3) 配制时,其正确的操作顺序是(字母表示,每个字母只能用一次);
A、用30mL水洗涤烧杯2﹣3次,洗涤液均注入容量瓶,振荡
B、用天平准确称取所需的NaOH的质量,加入少量水(约30mL),用玻璃棒慢慢搅动,使其充分溶解
C、将已冷却的NaOH溶液沿玻璃棒注入250mL的容量瓶中
D、将容量瓶盖紧,颠倒摇匀
E、改用胶头滴管加水,使溶液凹面恰好与刻度相切
F、继续往容量瓶内小心加水,直到液面接近刻度1﹣2cm处
-
(4) 下列配制的溶液浓度偏低的是 ;A . 称量NaOH时,砝码错放在左盘 B . 向容量瓶中转移溶液时(实验步骤C)不慎有液滴洒在容量瓶外面 C . 加蒸馏水时不慎超过了刻度线 D . 定容时俯视刻度线 E . 配制前,容量瓶中有少量蒸馏水.
阿伏加德罗常熟的值为NA . 下列说法正确的是( )
A . 1L0.1mol•L﹣1NH4CL溶液中,NH4+的数量为0.1NA
B . 2.4gMg与H2SO4完全反应,转移的电子数为0.1NA
C . 标准状况下,2.24LN2和O2的混合气体中分子数为0.2NA
D . 0.1mol H2和0.1mol I2于密闭容器中充分反应后,其分子总数为0.2NA
容量瓶上需要标有:①温度,②浓度,③容量,④压强,⑤刻度线,⑥碱式或酸式六项中的( )
A . ①③⑤
B . ②④⑥
C . ③⑤⑥
D . ①②③
设NA为阿伏加德罗常数的值,下列有关叙述正确的是( )
A . 常温常压下,3.2g肼(N2H4)中含有的共价键数目为0.4NA
B . 标准状况下,4.48LCO2和N2O的混合气体中含有的电子数为4.4NA
C . 0.5L0.5mol·L-1醋酸溶液中含有的分子数目小于0.25NA
D . 常温常压下,NaH与水反应产生2g氢气时,转移电子数为2NA
烧杯中装有50mLH2SO4和 Na2SO4 的混合液,其浓度分别为 0.16mol/L 和 2mol/L,欲使其浓度 分别变为 1.6mol/L 和 0.2mol/L,在只有蒸馏水和 18mol/L 浓H2SO4以及必要仪器的条件下,完成任务:
-
(1) 如图所示仪器,配制上述溶液不需用到的是(填字母).配制过程中还缺少的玻璃仪器是(填仪器名称)
-
(2) 在定容操作时,因不慎加水致凹液面最低处超过了刻度线,该如何处理:
-
(3) 下列操作可能引起所配溶液浓度偏高的有_____A . 容量瓶中原来存有少量蒸馏水 B . 定容时,俯视观察刻度线 C . 将量筒洗涤 2﹣3 次,并将洗涤液全部转移至容量瓶中 D . 没有用蒸馏水洗烧杯 2﹣3 次,并将洗液移入容量瓶中
-
(4) 实验操作过程中,应量取mL18mol•L﹣1的浓 H 2SO4溶液.
100mL 0.3mol/L Na2SO4溶液和50mL 0.2mol/L Al2(SO4)3溶液混合后,溶液中SO42-的物质的量浓度约为( )
A . 0.20mol/L
B . 0.25mol/L
C . 0.4mol/L
D . 0.5mol/L
需要配制500 mL 0.5 mol·L-1氢氧化钠溶液,经测定实际所配氢氧化钠溶液的浓度为0.45 mol·L-1。可能的原因是( )
A . 称量氢氧化钠固体时砝码放反了
B . 容量瓶没有烘干
C . 转移时溶液没有冷却至室温
D . 定容时仰视读数
下列说法正确的是( )
A . 22g CO2含有0.5mol CO2分子,体积为11.2L
B . 3.2g O2和3.2g O3含氧原子的数目不相同
C . 3.01×1023个水分子的质量为9g
D . 1L 0.2mol/L CaCl2溶液中,Cl-数目为0.2×6.02×1023个
配制 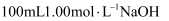 溶液的操作如下所示。下列说法错误的是( )
溶液的操作如下所示。下列说法错误的是( )
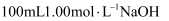 溶液的操作如下所示。下列说法错误的是( )
溶液的操作如下所示。下列说法错误的是( ) 
A . 操作1前称取  的质量为4.0g
B . 操作2前
的质量为4.0g
B . 操作2前  溶液需恢复至室温
C . 操作3和操作4分别为洗涤和定容
D . 操作5后液面下降,需补充少量水至刻度线
溶液需恢复至室温
C . 操作3和操作4分别为洗涤和定容
D . 操作5后液面下降,需补充少量水至刻度线
 的质量为4.0g
B . 操作2前
的质量为4.0g
B . 操作2前  溶液需恢复至室温
C . 操作3和操作4分别为洗涤和定容
D . 操作5后液面下降,需补充少量水至刻度线
溶液需恢复至室温
C . 操作3和操作4分别为洗涤和定容
D . 操作5后液面下降,需补充少量水至刻度线
H2C2O4·2H2O是一种无色晶体,在实验室常用作络合剂、掩蔽剂、沉淀剂、还原剂以及用于校准高锰酸钾标准溶液等。
回答下列问题:
-
(1) 实验室需配制0.1 mol·L-1的H2C2O4溶液250 mL。若用H2C2O4·2H2O配制,需用托盘天平称量H2C2O4·2H2O质量为g;若用H2C2O4溶液稀释配制,需量取2 mol·L-1的H2C2O4溶液的体积为mL。
-
(2) 用H2C2O4·2H2O配制时,涉及称量、溶解、溶液转移、定容等操作。
①下列图示对应的操作规范的是(填字母,下同)。
A.称量
 B.溶解
B.溶解 
C.转移溶液
 D.定容
D.定容 
②下列操作会导致配得的溶液浓度偏高的是。
A.所用的H2C2O4·2H2O晶体中含有少量无水的H2C2O4
B.溶解时,洗涤烧杯及玻璃棒的溶液未转移到容量瓶中
C.定容时,视线如图所示:

D.摇匀后发现液面低于刻度线,用胶头滴管滴加水到刻度线处
-
(3) 利用反应5H2C2O4+3H2SO4+2KMnO4=K2SO4+2MnSO4+8H2O+10CO2↑可校准KMnO4标准溶液。精确称取0.7875 g H2C2O4·2H2O,加入适量稀硫酸,然后向其中滴入KMnO4溶液,消耗KMnO4溶液50.00 mL,则KMnO4溶液的物质的量浓度为。
最近更新



