第二节 离子反应 知识点题库
下列说法正确的是( )
A . 氯化钾溶液在电流作用下电离成钾离子和氯离子
B . 二氧化硫溶于水能部分转化成离子,故二氧化硫属于弱电解质
C . 纯净的电解质在液态时,有的导电有的不导电
D . 硫酸钡难溶于水,所以硫酸钡属弱电解质
三组物质中每组均有甲、乙、丙三种物质(酸、碱、盐均为溶液).
第Ⅰ组 | 第Ⅱ组 | 第Ⅲ组 | |
甲 | BaCl2 | HCl | Cu(NO3)2 |
乙 | Fe2O3 | K2SO4 | H2SO4 |
丙 | Fe | NaOH | MgCl2 |
根据该表回答问题:
-
(1) 第Ⅲ组中有一种物质能与第组中的所有物质反应,这种物质是;
-
(2) 第Ⅱ组物质中,跟第Ⅰ组中所有物质都不能发生反应的是,该物质能与第Ⅲ组中所有物质发生反应,其化学方程式分别为
对下列实验过程的评价,正确的是( )
A . 某固体中加入稀盐酸,产生了无色气体,证明该固体中一定含有碳酸盐
B . 验证溶液中是否含有Cl﹣ , 加稀硝酸酸化的AgNO3溶液,有白色沉淀,证明含Cl﹣
C . 加入碳酸钠溶液产生白色沉淀,再加盐酸白色沉淀消失,一定有Ba2+
D . 某溶液中滴加盐酸酸化的BaCl2溶液,生成白色沉淀,证明一定含有SO42﹣
一种含铝、锂、钴的新型电子材料,生产中产生的废料数量可观,废料中的铝以金属铝箔的形式存在;钴以Co2O3•CoO的形式存在,吸附在铝箔的单面或双面;锂混杂于其中.

-
(1) 过程I中采用NaOH溶液溶出废料中的Al,反应的化学反应方程式为.
-
(2) 过程II中加入稀H2SO4酸化后,再加入Na2S2O3溶液浸出钴.则浸出钴的离子反应方程式为(产物中只有一种酸根).请从反应原理分析不用盐酸酸化的主要原因.
-
(3) 碳酸钠溶液在过程III和IV中所起作用有所不同,请分别用离子方程式表示在过程III、IV中起的作用:.
-
(4) 某天然碱的化学式可表示为2Na2CO3•NaHCO3•2H2O,取少量该物质溶于水得稀溶液P.下列有关溶液P中微粒的物质的量浓度关系正确的是 (填序号).A . c(CO32﹣)>c(HCO3﹣)>c(OH﹣)>c(H+) B . c(OH﹣)=c(H+)+c(HCO3﹣)+2c(H2CO3) C . 3c(Na+)>5c(CO32﹣)+5c(HCO3﹣)+5c(H2CO3) D . 将P溶液与少量NaOH溶液混合:c(Na+)+c(H+)=c(HCO3﹣)+2c(CO32﹣)+c(OH﹣)
-
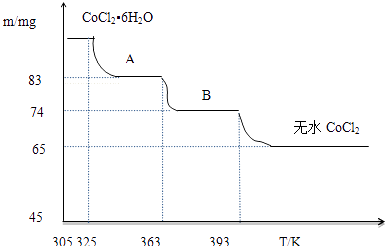
(5) CoO溶于盐酸可得粉红色的CoCl2溶液.CoCl2含结晶水数目不同而呈现不同颜色,利用蓝色的无水CoCl2吸水变色这一性质可制成变色水泥和显隐墨水.如图是粉红色的CoCl2•6H2O晶体受热分解时,剩余固体质量随温度变化的曲线,B物质的化学式是.
2017年3月21日是第二十五届“世界水日”,保护水资源,合理利用废水节省水资源,加强废水的回收利用已被越来越多的人所关注。已知:某无色废水中可能含有H+、NH4+、Fe3+、Al3+、Mg2+、Na+、NO3-、CO32-、SO42-中的几种,为分析其成分,分别取废水样品100 mL,进行了三组实验,其操作和有关图像如下所示:
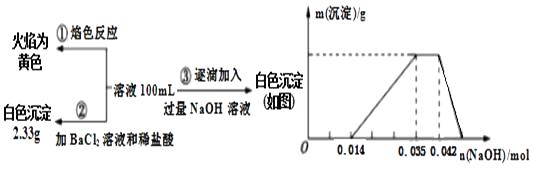
请回答下列问题:
-
(1) 根据上述3组实验可以分析废水中一定不存在的阴离子是,一定存在的阳离子是。
-
(2) 写出实验③图像中沉淀达到最大量且质量不再发生变化阶段发生反应的离子反应方程式:。
-
(3) 分析图像,在原溶液中c(NH4+)与c(Al3+)的比值为,所得沉淀的最大质量是g。
-
(4) 若通过实验确定原废水中c(Na+)=0.14 mol·L-1,试判断原废水中NO3-是否存在?(填“存在”“不存在”或“不确定”)。若存在,c(NO3-)= mol·L-1。(若不存在或不确定则此空不填)
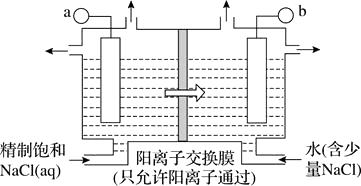
ClO2为一种黄绿色气体,是目前国际上公认的高效、广谱、快速安全的杀菌剂。制备ClO2的新工艺是电解法。
-
(1) 如图所示用石墨做电极,在一定条件下电解饱和食盐水制取ClO2 , 写出阳极产生ClO2的电极方程式:;图中b电极为(填“阳极”或“阴极”)。
-
(2) 电解一段时间,当阴极产生标准状况下气体112 mL时,停止电解,则通过阳离子交换膜的阳离子物质的量为 mol,阴极区pH(填“变大”“变小”或“不变”)。
-
(3) ClO2对污水中Fe2+、Mn2+、S2-、CN-等有明显去除效果,某工厂中污水含CN-(a mol·L-1),现将ClO2把CN-氧化成两种无毒气体,写出该反应的离子方程式: 。
某100mL溶液可能含有Na+、NH4+、Fe3+、CO32﹣、SO42﹣、Cl﹣中的若干种,取该溶液进行连续实验,实验过程如图:(所加试剂均过量,气体全部逸出)下列说法错误的是( )
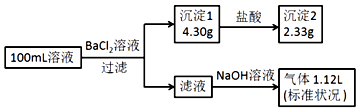
A . 原溶液一定存在CO32﹣和SO42﹣ , 一定不存在Fe3+
B . 原溶液一定存在Cl﹣ , 可能存在Na+
C . 原溶液中c(Cl﹣)≥0.1mol•L﹣1
D . 若原溶液中不存在Na+ , 则c(Cl﹣)<0.1mol•L﹣1
向某NaOH溶液中通入CO2气体后得到溶液M,因CO2通入的量不同,溶液M的组成也不同,若向溶液M中逐滴加入盐酸,产生的气体体积V(CO2)与加入盐酸的体积V(HCl)的关系如图所示。则下列分析与判断错误的是(不计CO2溶解)( )
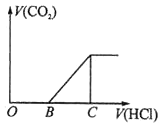
A . 若OB=0,则形成溶液的过程中所发生反应的离子方程式为OH―+CO2═HCO3―
B . 若OB=BC,则溶液M为Na2CO3溶液
C . 若OB>BC,则溶液M中大量存在的阴离子为CO32―和HCO3―
D . 若3OB=BC,则溶液M中c(NaHCO3)=2c(Na2CO3)
今有 11 种物质:
①铝线 ②石墨 ③氯气 ④BaSO4 晶体 ⑤纯硫酸 ⑥金刚石 ⑦石灰水 ⑧乙醇 ⑨熔融的 KNO3 ⑩二氧化硫 ⑪盐酸
其中:
-
(1) 能导电的是(填序号,下同);
-
(2) 属于电解质的是;
-
(3) 属于非电解质的是。
符合如下实验过程和现象的试剂组是( )
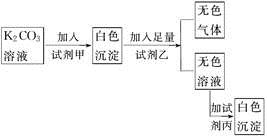
| 甲 | 乙 | 丙 |
| A.MgCl2 | HNO3 | K2SO4 |
| B.BaCl2 | HNO3 | K2SO4 |
| C.NaNO3 | H2SO4 | Ba(NO3)2 |
| D.BaCl2 | HCl | CaCl2 |
A . A
B . B
C . C
D . D
以硅孔雀石[主要成分为CuCO3·Cu(OH)2、CuSiO3·2H2O,含SiO2、FeCO3、Fe2O3等杂质]为原料制备CuCl2的工艺流程如下:
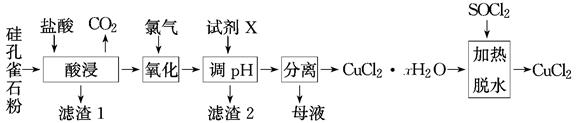
已知:SOCl2+H2O  SO2↑+2HCl↑
SO2↑+2HCl↑
-
(1) “酸浸”时盐酸与CuCO3·Cu(OH)2反应的化学方程式为。
检验“酸浸”后浸出液中的Fe3+可用溶液。
-
(2) “氧化”时发生反应的离子方程式为。
-
(3) “滤渣2”的主要成分为(填化学式);“调pH”时,pH不能过高,其原因是。
-
(4) “加热脱水”时,加入SOCl2的目的是。
实验室中用电解水的方法制取氢气和氧气,为了增强溶液的导电性最好加入下列电解质中的( )
A . NaCl
B . Na2SO4
C . CuCl2
D . AgNO3
下列关于离子共存或离子反应的说法正确的是( )
A . pH=2的溶液中可能大量存在Na+、  、
、  B . 某无色溶液中可能大量存在H+、Cl-、
B . 某无色溶液中可能大量存在H+、Cl-、  C . Fe2+与H2O2在酸性溶液中的反应:2Fe2++H2O2+2H+=2Fe3++2H2O
D . 稀硫酸与Ba(OH)2溶液的反应:H++
C . Fe2+与H2O2在酸性溶液中的反应:2Fe2++H2O2+2H+=2Fe3++2H2O
D . 稀硫酸与Ba(OH)2溶液的反应:H++  +Ba2++OH-=BaSO4↓+H2O
+Ba2++OH-=BaSO4↓+H2O
 、
、  B . 某无色溶液中可能大量存在H+、Cl-、
B . 某无色溶液中可能大量存在H+、Cl-、  C . Fe2+与H2O2在酸性溶液中的反应:2Fe2++H2O2+2H+=2Fe3++2H2O
D . 稀硫酸与Ba(OH)2溶液的反应:H++
C . Fe2+与H2O2在酸性溶液中的反应:2Fe2++H2O2+2H+=2Fe3++2H2O
D . 稀硫酸与Ba(OH)2溶液的反应:H++  +Ba2++OH-=BaSO4↓+H2O
+Ba2++OH-=BaSO4↓+H2O
某无色透明溶液中可能含有下列离子中的一种或几种:Na+、Mg2+、Cu2+、OH-、Cl-、CO  、NO
、NO  。现进行如下检验:
。现进行如下检验:
 、NO
、NO  。现进行如下检验:
。现进行如下检验:
-
(1) 不用做任何实验,就可以排除的离子是
-
(2) 用红色石蕊试纸检验,试纸变蓝色,可确定溶液中一定存在的离子是,同时排除的离子是
-
(3) 另取少量溶液逐滴滴加盐酸至过量,无气体放出,由此可以确定溶液中无
-
(4) 另取少量溶液用硝酸酸化后,加入AgNO3溶液有白色沉淀生成,写出反应的离子方程式
下列反应不能发生的是( )
A . KHCO3 + HCl = KCl + CO2 + H2O
B . AgNO3 + NaCl = AgCl + NaNO3
C . Cu + 2AgNO3 = Cu(NO3)2 + 2Ag
D . 2HCl + Na2SO4 = 2NaCl + H2SO4
下表中为元素周期表的一部分,请参照元素①~⑧在表中的位置,请用化学用语回答下列问题:
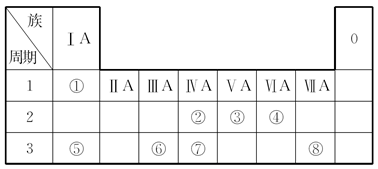
-
(1) 在①~⑧元素中,原子半径最大;④、⑤、⑥的离子半径由大到小的顺序为。
-
(2) ②、⑦、⑧的最高价氧化物对应的水化物的酸性由强到弱的顺序是。
-
(3) ③、④、⑦的气态氢化物的稳定性由强到弱的顺序是。
-
(4) ⑥、⑧的最高价氧化物对应的水化物之间能发生化学反应的离子方程式为。
-
(5) 往Na2SiO3的水溶液中通入足量的CO2 , 其反应的离子方程式为。
下列各组离子在溶液中能大量共存且为无色的是( )
A . H+、Cl-、Ag+、NO  B . Na+、CO
B . Na+、CO  、Cl-、Ca2+
C . Fe3+、SO
、Cl-、Ca2+
C . Fe3+、SO  、Na+、Cl-
D . H+、Ba2+、Cl-、NO
、Na+、Cl-
D . H+、Ba2+、Cl-、NO 
 B . Na+、CO
B . Na+、CO  、Cl-、Ca2+
C . Fe3+、SO
、Cl-、Ca2+
C . Fe3+、SO  、Na+、Cl-
D . H+、Ba2+、Cl-、NO
、Na+、Cl-
D . H+、Ba2+、Cl-、NO 
某工业废水中存在大量的Na+、Cl-、Cu2+、SO , 欲除去其中的Cu2+、SO
, 欲除去其中的Cu2+、SO , 设计工艺流程如图所示:
, 设计工艺流程如图所示:
 , 欲除去其中的Cu2+、SO
, 欲除去其中的Cu2+、SO , 设计工艺流程如图所示:
, 设计工艺流程如图所示:
-
(1) 试剂a溶液为,试剂 b溶液为。
-
(2) 操作X为,试剂 a、b(填“能”或“不能”)对调顺序。
-
(3) 如果在工业废水中直接加入氢氧化钡溶液,写出发生反应的离子方程式。
-
(4) 如何检验废水中的SO
 已除尽(写出对应的操作及现象)。
已除尽(写出对应的操作及现象)。
下列离子方程式书写正确的是( )
A . 用醋酸除去水垢: B . 铝粉和NaOH溶液反应制取少量H2:
B . 铝粉和NaOH溶液反应制取少量H2: C . NO2通入水中制硝酸:
C . NO2通入水中制硝酸: D . 电解饱和食盐水:
D . 电解饱和食盐水:
 B . 铝粉和NaOH溶液反应制取少量H2:
B . 铝粉和NaOH溶液反应制取少量H2: C . NO2通入水中制硝酸:
C . NO2通入水中制硝酸: D . 电解饱和食盐水:
D . 电解饱和食盐水:
N2O、NO和NO2等氮氧化物是空气污染物,含有氨氧化物的尾气需处理后才能排放。
-
(1) N2O的处理。N2O是硝酸生产中氨催化氧化的副产物,用特种催化剂能使N2O分解。NH3与O2在加热和催化剂作用下生成N2O的化学方程式为。
-
(2) NO的氧化吸收。用NaClO溶液吸收硝酸尾气,可提高尾气中NO的去除率。在酸性溶液中,HClO氧化NO生成Cl-和
 , 其离子方程式为。
, 其离子方程式为。
-
(3) NO和NO2的处理。工业上用石灰乳吸收已除去N2O的硝酸尾气(含NO、NO2),既能净化尾气,又能获得应用广泛的Ca(NO2)2 , 其部分工艺流程如下:
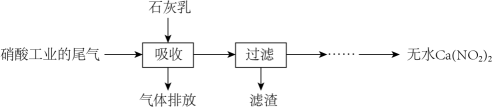
①上述工艺中采用气—液逆流接触吸收(尾气从吸收塔底进入,石灰乳从塔顶喷淋),其目的是;滤渣可循环使用,其主要成分是(填化学式)。
②过滤后的滤液经、、过滤、洗涤、干燥,得到无水Ca(NO2)2。
最近更新



