第二节 离子反应 知识点题库
下列物质中能导电的是( )
A . 稀硫酸
B . 蔗糖
C . CuSO4•5H2O
D . NaCl固体
有一瓶无色澄清的溶液,可能由以下离子中的几种组成:SO32﹣、I﹣、CO32﹣、Cl﹣、SO42﹣、Fe2+、Na+、MnO4﹣请根据以下实验步骤及现象回答问题:
步骤一:取适量待测液,加入足量稀盐酸,产生有刺激性气味的气体A和溶液B.
步骤二:往B中加入足量BaCl2溶液,得白色沉淀和溶液C.
步骤三:往C溶液中通入足量Cl2 , 得黄色溶液D.
-
(1) 该溶液中一定存在的离子是:.
-
(2) 该溶液中可能存在的阴离子是:.
-
(3) 步骤三中溶液变黄可能是因为生成了:(填化学式);确认其存在的实验操作与现象是:取适量D溶液于试管中,.
下列关于物质分类的说法正确的是( )
A . 根据分散系是否具有丁达尔现象将分散系分为溶液、胶体和浊液
B . 根据酸分子中含有的氢原子个数可将酸分为一元酸、二元酸、三元酸等
C . 镁铝合金、漂白粉、水玻璃、王水均为混合物
D . 纯碱、熟石灰、醋酸、食盐水均为电解质
①H2SO4、②过氧化钠、③碳酸氢钠、④二氧化硅是常见的物质。请回答下列问题。
-
(1) 上述四种物质分别加入到紫色石蕊溶液中,溶液变红的是(填序号)。
-
(2) 写出H2SO4 的电离方程式。
-
(3) 写出过氧化钠与水反应的化学方程式。
-
(4) 碳酸氢钠可治疗胃酸(0.2%~0.4%的盐酸)过多,反应的离子方程式为。
-
(5) 写出二氧化硅与氢氧化钠溶液反应的离子方程式。
下列指定反应的离子方程式正确的是( )
A . Cu与FeCl3溶液的反应:Cu+2Fe3+=Cu2++2Fe2+
B . Na2SiO3溶液中加入盐酸:Na2SiO3+2H+=H2SiO3↓+2Na+
C . AgCl悬浊液中加入KI溶液得到黄色沉淀:Ag++I-=AgI↓
D . AlCl3溶液中加入过量氨水:Al3++4NH3·H2O=AlO2-+4NH4++2H2O
某无色溶液中可能含有Mg2+、Ba2+、Cl-、CO  、Cu2+、Fe3+中的一种或几种离子。为确定其成分,进行以下实验:
、Cu2+、Fe3+中的一种或几种离子。为确定其成分,进行以下实验:
实验1:取10mL无色溶液,滴加过量稀盐酸无明显现象。
实验2:另取10mL无色溶液,加入足量的Na2SO4溶液,有白色沉淀生成。
实验3:取实验1后的溶液于锥形瓶中,向锥形瓶中逐滴加入NaOH溶液,滴加过程中产生沉淀的质量与加入NaOH溶液的体积的关系如图所示。
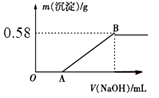
回答下列问题:
-
(1) 原溶液中不存在的离子是,存在的离子是。
-
(2) 实验3中,图像中OA段反应的离子方程式为。
-
(3) 根据图像计算原溶液中Mg2+的物质的量浓度。
下列指定反应的离子方程式正确的是( )
A . 澄清石灰水与过量苏打溶液混合:Ca2++2OH-+2HCO3-=CaCO3↓+CO32-+2H2O
B . 少量SO2通入饱和的漂白粉溶液中:ClO-+SO2+H2O=SO42-+2H++Cl-
C . 向热的稀硫酸中加入铜粉并鼓入空气:2Cu+4H++O2  2Cu2++2H2O
D . 向酸性高锰酸钾溶液中滴加少量双氧水:7H2O2+2MnO4-+6H+=2Mn2++6O2↑+10H2O
2Cu2++2H2O
D . 向酸性高锰酸钾溶液中滴加少量双氧水:7H2O2+2MnO4-+6H+=2Mn2++6O2↑+10H2O
 2Cu2++2H2O
D . 向酸性高锰酸钾溶液中滴加少量双氧水:7H2O2+2MnO4-+6H+=2Mn2++6O2↑+10H2O
2Cu2++2H2O
D . 向酸性高锰酸钾溶液中滴加少量双氧水:7H2O2+2MnO4-+6H+=2Mn2++6O2↑+10H2O
A,B,C,D为四种可溶性的盐,它们包含的阳离子和阴离子分别为Ba2+、Ag+、Na+、Cu2+和NO3-、SO42﹣、Cl-、CO32-(离子在物质中不能重复出现)。
① 若把四种盐分别溶于盛有蒸馏水的四支试管中,只有C盐的溶液呈蓝色;
② 若向①的四支试管中分别加入盐酸,B盐的溶液有沉淀生成,D盐的溶液有无色无味的气体逸出。
根据①②实验事实可推断它们的化学式为:
-
(1) A D ;
-
(2) 写出盐酸与B反应的离子方程式:;
-
(3) 将含相同物质的量A、
B、C的溶液混合后,混合后溶液中存在的离子为;在此溶液中加入铁粉,写出发生反应的离子方程式;
-
(4) A溶液中阴离子的检验方法:。
下列各组离子在水溶液中能大量共存的是( )
A . Cl-、SO32-、Fe2+、H+
B . K+、Fe3+、NO3-、SCN-
C . NH4+、Ba2+、Br、CO32-
D . K+、Na+、SO42-、MnO4-
铝是地壳中含量最多的金属元素,其单质和化合物广泛应用于日常生活中。
-
(1) 铝粉和铁的氧化物(FeO-Fe2O3)可配成铝热剂用于焊接钢轨,反应的化学方程式是。
-
(2) 以铝土矿(主要成分为Al2O3.含SiO2和Fe2O3等杂质)为原料生产铝和铵明矾晶体[NH4Al(SO4)2·12H2O]的一种工艺流程如下(已知:SiO2在“碱溶”时转化为铝硅酸钠(NaAlSiO4·nH2O)沉淀)。

①实验前,要将铝土矿粉粹的目的是。
②用氧化物的形式表示铝硅酸钠的化学式。
③步骤②涉及到的离子方程式是: 。
④写出利用Al2O3制备金属Al的化学方程式: 。
⑤若同时制取铵明矾和硫酸铝,通过控制硫酸的用量调节两种产品的产量。若欲使制得的铵明矾和硫酸铝的物质的量之比为1 : 1,则投料时铝土矿中的Al2O3和H2SO4的物质的量之比为。
下列物质在水溶液中的电离方程式正确的是( )
A . NaHCO3=Na++H++CO32-
B . NaHSO4=Na++H++SO42-
C . H2CO3=H++HCO3-
D . KClO3=K++Cl-+3O2-
下列说法正确的是( )
A . 氯化钠晶体不导电是没有离子存在
B . 石墨能导电,但是石墨既不是电解质也不是非电解质
C . KNO3在电流作用下在水中电离出K+ 和NO3-
D . 液态氯化氢存在着自由移动的氯离子
完成下列填空
-
(1) 下列两组物质中,均有一种物质的类别与其它三种不同:
A.MgO、Na2O、CO2、CuO
B.NaOH、Na2CO3、KOH、Cu(OH)2
这两种物质依次是(填化学式):A;B.
-
(2) ①NaCl(S) ②HCl(l) ③Cu ④酒精 ⑤液态醋酸⑥KNO3溶液填空回答(填序号):以上物质中能导电的是;属于电解质的是;属于非电解质的是;属于弱电解质的是.
某溶液中含有较大量的Cl-、CO32-、OH- , 如果只取一次该溶液就能够分别将3种阴离子依次检验出来,正确的操作顺序是 ( )
①滴加Mg(NO3)2溶液 ②过滤 ③滴加AgNO3溶液 ④滴加Ba(NO3)2溶液
A . ①②④②③
B . ④②①②③
C . ①②③②④
D . ④②③②①
下列离子方程式或热化学方程式与所述事实不相符的是( )
A . 向显蓝色的淀粉溶液中通入足量SO2后溶液变无色:I2+SO2+2H2O=2I-+SO  +4H+
B . 用Na2S处理含Hg2+的废水:Hg2++S2-=HgS↓
C . 向Mg(OH)2悬浊液中滴加足量FeCl3溶液出现红褐色沉淀:3Mg(OH)2+2Fe3+=2Fe(OH)3+3Mg2+
D . 298K、101kPa,将0.5molN2和1.5molH2置于密闭容器中,充分反应生成NH3(g),放热19.3kJ。其热化学方程式为:N2(g)+3H2(g)
+4H+
B . 用Na2S处理含Hg2+的废水:Hg2++S2-=HgS↓
C . 向Mg(OH)2悬浊液中滴加足量FeCl3溶液出现红褐色沉淀:3Mg(OH)2+2Fe3+=2Fe(OH)3+3Mg2+
D . 298K、101kPa,将0.5molN2和1.5molH2置于密闭容器中,充分反应生成NH3(g),放热19.3kJ。其热化学方程式为:N2(g)+3H2(g)  2NH3(g) △H=-38.6kJ•mol-1
2NH3(g) △H=-38.6kJ•mol-1
 +4H+
B . 用Na2S处理含Hg2+的废水:Hg2++S2-=HgS↓
C . 向Mg(OH)2悬浊液中滴加足量FeCl3溶液出现红褐色沉淀:3Mg(OH)2+2Fe3+=2Fe(OH)3+3Mg2+
D . 298K、101kPa,将0.5molN2和1.5molH2置于密闭容器中,充分反应生成NH3(g),放热19.3kJ。其热化学方程式为:N2(g)+3H2(g)
+4H+
B . 用Na2S处理含Hg2+的废水:Hg2++S2-=HgS↓
C . 向Mg(OH)2悬浊液中滴加足量FeCl3溶液出现红褐色沉淀:3Mg(OH)2+2Fe3+=2Fe(OH)3+3Mg2+
D . 298K、101kPa,将0.5molN2和1.5molH2置于密闭容器中,充分反应生成NH3(g),放热19.3kJ。其热化学方程式为:N2(g)+3H2(g)  2NH3(g) △H=-38.6kJ•mol-1
2NH3(g) △H=-38.6kJ•mol-1
-
(1) I、在调水工程中,沿途工业污水的任意排放是造成水质恶化的最大隐患.检测某工厂废液中,含有大量的
 、
、  、
、  、
、 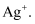 试分析:
试分析: 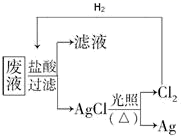
该废液中可能大量存在的一种阴离子是
 选填序号
选填序号  .
.A.


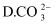
-
(2) 检验废液中铝元素的含量,需将其从废水样品中分离出来,所用的试剂可以是,铝元素发生变化的离子方程式是。
-
(3) 为了回收废液中的金属银,某同学设计了如下方案:若依该方案获得银
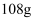 ,为保证不污染环境和氯气的循环利用,理论上应提供标准状况下的氢气L。
,为保证不污染环境和氯气的循环利用,理论上应提供标准状况下的氢气L。
-
(4) II、某无色透明溶液,投入金属铝可放出
 。现有下列离子:
。现有下列离子:  、
、  、
、  、
、  、
、  、
、  、
、  、
、 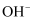 。试判断下列两种情况时,各有哪些离子可存在于此溶液中:
。试判断下列两种情况时,各有哪些离子可存在于此溶液中: 当生成
 时,可存在的离子有;
时,可存在的离子有; -
(5) 当生成
 时,可存在的离子有。
时,可存在的离子有。
下列各组离子在溶液中能大量共存的是( )
A . Na+ Al3+ Cl- SO  B . Cu2+ Cl- NO
B . Cu2+ Cl- NO  OH-
C . Ca2+ Na+ CO
OH-
C . Ca2+ Na+ CO  NO
NO  D . H+ SO
D . H+ SO  NO
NO  HCO
HCO 
 B . Cu2+ Cl- NO
B . Cu2+ Cl- NO  OH-
C . Ca2+ Na+ CO
OH-
C . Ca2+ Na+ CO  NO
NO  D . H+ SO
D . H+ SO  NO
NO  HCO
HCO 
下列物质属于电解质,且溶于水为碱性的是( )
A . NaCl
B . NaHCO3
C . CO2
D . 氨水
常温下,下列各组离子在给定溶液中能大量共存的是( )
A . pH=1的溶液:Fe2+、Mg2+、  、
、  B . pH=12的溶液:K+、Na+、
B . pH=12的溶液:K+、Na+、  、
、  C . pH=7的溶液:Na+、Cu2+、S2-、Cl-
D . pH=7的溶液:Al3+、K+、Cl-、
C . pH=7的溶液:Na+、Cu2+、S2-、Cl-
D . pH=7的溶液:Al3+、K+、Cl-、 
 、
、  B . pH=12的溶液:K+、Na+、
B . pH=12的溶液:K+、Na+、  、
、  C . pH=7的溶液:Na+、Cu2+、S2-、Cl-
D . pH=7的溶液:Al3+、K+、Cl-、
C . pH=7的溶液:Na+、Cu2+、S2-、Cl-
D . pH=7的溶液:Al3+、K+、Cl-、 
能符合题意表示下列反应的离子方程式的是( )
A . 往FeI2溶液中通入少量 B . 将水垢浸泡在醋酸中
B . 将水垢浸泡在醋酸中 C . NaOH溶液与过量Ca(HCO3)2溶液反应
C . NaOH溶液与过量Ca(HCO3)2溶液反应 D . 向NaAlO2溶液中通入过量
D . 向NaAlO2溶液中通入过量
 B . 将水垢浸泡在醋酸中
B . 将水垢浸泡在醋酸中 C . NaOH溶液与过量Ca(HCO3)2溶液反应
C . NaOH溶液与过量Ca(HCO3)2溶液反应 D . 向NaAlO2溶液中通入过量
D . 向NaAlO2溶液中通入过量
最近更新



