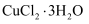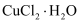第дәҢиҠӮ зҰ»еӯҗеҸҚеә” зҹҘиҜҶзӮ№йўҳеә“


в‘ е°ҶеӣәдҪ“ж··еҗҲзү©жә¶дәҺж°ҙпјҢжҗ…жӢҢеҗҺеҫ—ж— иүІйҖҸжҳҺжә¶ж¶Іпјӣ
в‘ЎеҫҖжӯӨжә¶ж¶Ідёӯж»ҙеҠ BaCl2жә¶ж¶ІпјҢжңүзҷҪиүІжІүж·Җз”ҹжҲҗпјӣ
в‘ўиҝҮж»ӨпјҢе°ҶжІүж·Җзү©зҪ®дәҺи¶ійҮҸзЁҖзЎқй…ёдёӯпјҢеҸ‘зҺ°жІүж·Җе…ЁйғЁжә¶и§ЈпјҺ
иҜ•еҲӨж–ӯпјҡ
-
пјҲ1пјү еӣәдҪ“ж··еҗҲзү©дёӯиӮҜе®ҡжңүпјҢиӮҜе®ҡжІЎжңүпјҢеҸҜиғҪжңүпјҺ
-
пјҲ2пјү еҶҷеҮәжңүе…ізҡ„зҰ»еӯҗж–№зЁӢејҸпјҡе®һйӘҢв‘Ўпјӣе®һйӘҢв‘ўпјҺ

дёӢеҲ—иҜҙжі•й”ҷиҜҜзҡ„жҳҜпјҲ пјү
 2LiFePO4+H2O+3CO2вҶ‘
2LiFePO4+H2O+3CO2вҶ‘ жё©еәҰ/  | 30 | 35 | 40 | 45 | 50 |
| TiO2 В·xH2OиҪ¬еҢ–зҺҮ/% | 92 | 95 | 97 | 93 | 88 |
е·ІзҹҘпјҡв… пјҺZnSO3В· 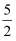 H2Oеҫ®жә¶дәҺж°ҙпјҢZnSO4жҳ“жә¶дәҺж°ҙгҖӮ
H2Oеҫ®жә¶дәҺж°ҙпјҢZnSO4жҳ“жә¶дәҺж°ҙгҖӮ
в…Ў.25в„ғж—¶пјҢжә¶ж¶ІдёӯSпјҲ+4д»·пјүеҗ„з»„еҲҶзҡ„зү©иҙЁзҡ„йҮҸеҲҶж•°йҡҸpHеҸҳеҢ–жӣІзәҝеҰӮдёӢеӣҫгҖӮ

в…ўпјҺO3дёәејәж°§еҢ–еүӮпјҢ1 mol O3иў«иҝҳеҺҹиҪ¬з§»2 mol eвҲ’ пјҢ еҗҢж—¶з”ҹжҲҗ1 mol O2гҖӮ
-
пјҲ1пјү SO2йҖ жҲҗзҡ„зҺҜеўғй—®йўҳдё»иҰҒжҳҜгҖӮ
-
пјҲ2пјү ZnOе°ҶSO2иҪ¬еҢ–дёәZnSO3В·
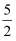 H2Oзҡ„еҢ–еӯҰж–№зЁӢејҸжҳҜгҖӮ
H2Oзҡ„еҢ–еӯҰж–№зЁӢејҸжҳҜгҖӮ
-
пјҲ3пјү е°ҶZnSO3В·
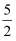 H2OжӮ¬жөҠж¶ІиҪ¬еҢ–дёәZnSO4ж—¶пјҢеӣ е…¶иў«O2ж°§еҢ–зҡ„йҖҹзҺҮеҫҲж…ўпјҢжҳ“йҖ жҲҗз®ЎйҒ“е өеЎһпјҢе®һйӘҢе®ӨжЁЎжӢҹO3ж°§еҢ–и§ЈеҶіиҜҘй—®йўҳгҖӮеҲқе§Ӣж—¶з”Ёзӣҗй…ёе°Ҷ5% ZnSO3жӮ¬жөҠж¶Іи°ғиҮі pHпјқ3.5пјҢд»ҘдёҖе®ҡзҡ„иҝӣж°”жөҒйҮҸйҖҡе…ҘO3 пјҢ з ”з©¶O3ж°§еҢ–ZnSO3В·
H2OжӮ¬жөҠж¶ІиҪ¬еҢ–дёәZnSO4ж—¶пјҢеӣ е…¶иў«O2ж°§еҢ–зҡ„йҖҹзҺҮеҫҲж…ўпјҢжҳ“йҖ жҲҗз®ЎйҒ“е өеЎһпјҢе®һйӘҢе®ӨжЁЎжӢҹO3ж°§еҢ–и§ЈеҶіиҜҘй—®йўҳгҖӮеҲқе§Ӣж—¶з”Ёзӣҗй…ёе°Ҷ5% ZnSO3жӮ¬жөҠж¶Іи°ғиҮі pHпјқ3.5пјҢд»ҘдёҖе®ҡзҡ„иҝӣж°”жөҒйҮҸйҖҡе…ҘO3 пјҢ з ”з©¶O3ж°§еҢ–ZnSO3В· 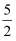 H2OпјҢе…¶дёӯжә¶ж¶ІpHйҡҸж—¶й—ҙеҸҳеҢ–зҡ„жӣІзәҝеҰӮдёӢпјҡ
H2OпјҢе…¶дёӯжә¶ж¶ІpHйҡҸж—¶й—ҙеҸҳеҢ–зҡ„жӣІзәҝеҰӮдёӢпјҡ 
в‘ pHпјқ3.5зҡ„жә¶ж¶Ідёӯеҗ«SпјҲ+4д»·пјүзҡ„зҰ»еӯҗдё»иҰҒжҳҜгҖӮ
в‘ЎдёҖж®өж—¶й—ҙеҗҺпјҢжә¶ж¶Ізҡ„pHеҮҸе°ҸпјҢжӯӨиҝҮзЁӢдёӯдё»иҰҒеҸҚеә”зҡ„зҰ»еӯҗж–№зЁӢејҸжҳҜгҖӮ
в‘ўи§ЈйҮҠO3ж°§еҢ–еҸҜйҳІжӯўз®ЎйҒ“е өеЎһзҡ„еҺҹеӣ пјҡгҖӮ
 NH4пјӢ+OHпјҚ
B . з”ЁжҳҺзҹҫ [KAl(SO4)2В·12H2O]дҪңеҮҖж°ҙеүӮпјҡAl3++3H2O
NH4пјӢ+OHпјҚ
B . з”ЁжҳҺзҹҫ [KAl(SO4)2В·12H2O]дҪңеҮҖж°ҙеүӮпјҡAl3++3H2O  Al(OH)3(иғ¶дҪ“)+3H+
C . з”ЁйҘұе’ҢNa2CO3жә¶ж¶ІеӨ„зҗҶж°ҙеһўдёӯзҡ„CaSO4(еҫ®жә¶)пјҡCa2++CO32пјҚ=CaCO3вҶ“
D . еҗ‘K2Cr2O7жә¶ж¶Ідёӯж»ҙеҠ е°‘йҮҸжө“H2SO4 пјҢ жә¶ж¶Іж©ҷиүІеҠ ж·ұпјҡ
Al(OH)3(иғ¶дҪ“)+3H+
C . з”ЁйҘұе’ҢNa2CO3жә¶ж¶ІеӨ„зҗҶж°ҙеһўдёӯзҡ„CaSO4(еҫ®жә¶)пјҡCa2++CO32пјҚ=CaCO3вҶ“
D . еҗ‘K2Cr2O7жә¶ж¶Ідёӯж»ҙеҠ е°‘йҮҸжө“H2SO4 пјҢ жә¶ж¶Іж©ҷиүІеҠ ж·ұпјҡ  (ж©ҷиүІ)+H2O
(ж©ҷиүІ)+H2O  2CrO42пјҚ(й»„иүІ)+2H+
2CrO42пјҚ(й»„иүІ)+2H+
 гҖҒMnO
гҖҒMnO  B . 0.1mol/L FeCl3жә¶ж¶Іпјҡ Ba2+гҖҒAl3+гҖҒSCN-гҖҒCl-
C . 0.1 mol/L NaClOжә¶ж¶Іпјҡ Na+гҖҒNH
B . 0.1mol/L FeCl3жә¶ж¶Іпјҡ Ba2+гҖҒAl3+гҖҒSCN-гҖҒCl-
C . 0.1 mol/L NaClOжә¶ж¶Іпјҡ Na+гҖҒNH  гҖҒCO
гҖҒCO  гҖҒSO
гҖҒSO  D .
D .  =0.1 mol/Lзҡ„жә¶ж¶Іпјҡ Na+гҖҒK+гҖҒAlO
=0.1 mol/Lзҡ„жә¶ж¶Іпјҡ Na+гҖҒK+гҖҒAlO  гҖҒBr-
гҖҒBr-
 зҡ„еҹәжң¬е®һйӘҢжӯҘйӘӨдёәв‘ жЈҖжҹҘиЈ…зҪ®ж°”еҜҶжҖ§пјӣв‘Ўе…ій—ӯKпјҢеҗ‘Bдёӯж»ҙе…Ҙ
зҡ„еҹәжң¬е®һйӘҢжӯҘйӘӨдёәв‘ жЈҖжҹҘиЈ…зҪ®ж°”еҜҶжҖ§пјӣв‘Ўе…ій—ӯKпјҢеҗ‘Bдёӯж»ҙе…Ҙ  жә¶ж¶ІпјҢеҲ¶еҫ—
жә¶ж¶ІпјҢеҲ¶еҫ— 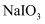 пјӣв‘ўжү“ејҖKпјҢйҖҡе…Ҙ
пјӣв‘ўжү“ејҖKпјҢйҖҡе…Ҙ  иҮійҘұе’ҢеҲ¶еҫ—
иҮійҘұе’ҢеҲ¶еҫ—  пјҢеҗҢж—¶жңүй»„иүІжІүж·Җдә§з”ҹпјӣв‘Је…ій—ӯKпјҢеҗ‘жүҖеҫ—жә¶ж¶ІдёӯеҠ е…ҘзЁҖзЎ«й…ёпјҢж°ҙжөҙеҠ зғӯпјҢе……еҲҶйҖёеҮә
пјҢеҗҢж—¶жңүй»„иүІжІүж·Җдә§з”ҹпјӣв‘Је…ій—ӯKпјҢеҗ‘жүҖеҫ—жә¶ж¶ІдёӯеҠ е…ҘзЁҖзЎ«й…ёпјҢж°ҙжөҙеҠ зғӯпјҢе……еҲҶйҖёеҮә  пјӣ
пјӣ в‘ӨжҠҠBдёӯзҡ„ж··еҗҲж¶ІеҖ’е…Ҙзғ§жқҜпјҢеҠ е…Ҙи¶ійҮҸзўій…ёй’ЎйҷӨеҺ»зЁҖзЎ«й…ёеҶҚз»ҸиҝҮдёҖзі»еҲ—ж“ҚдҪңеҫ—еҲ° 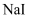 жҲҗе“ҒпјҺ
жҲҗе“ҒпјҺ

еӣһзӯ”дёӢеҲ—й—®йўҳпјҡ
-
пјҲ1пјү зӣӣзЁҖзЎ«й…ёе’Ң
 жә¶ж¶Ізҡ„д»ӘеҷЁпјҢиӢҘжҚўжҲҗеҲҶж¶ІжјҸж–—пјҢе…¶зјәзӮ№жҳҜпјҺ
жә¶ж¶Ізҡ„д»ӘеҷЁпјҢиӢҘжҚўжҲҗеҲҶж¶ІжјҸж–—пјҢе…¶зјәзӮ№жҳҜпјҺ
-
пјҲ2пјү AиЈ…зҪ®дёӯеҸ‘з”ҹеҸҚеә”зҡ„зҰ»еӯҗж–№зЁӢејҸдёәпјҢCиЈ…зҪ®зҡ„дҪңз”ЁдёәпјҺ
-
пјҲ3пјү жӯҘйӘӨв‘ЎеҸҜи§ӮеҜҹеҲ°зҡ„зҺ°иұЎжҳҜпјҺ
-
пјҲ4пјү еҲ¶еҫ—
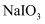 зҡ„зҰ»еӯҗж–№зЁӢејҸдёәпјҺйҖҡе…Ҙ
зҡ„зҰ»еӯҗж–№зЁӢејҸдёәпјҺйҖҡе…Ҙ  иҮійҘұе’ҢпјҢдёҺ
иҮійҘұе’ҢпјҢдёҺ 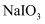 еҸҚеә”еҲ¶еҫ—
еҸҚеә”еҲ¶еҫ— 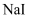 зҡ„зҰ»еӯҗж–№зЁӢејҸдёәпјҺ
зҡ„зҰ»еӯҗж–№зЁӢејҸдёәпјҺ
-
пјҲ5пјү жӯҘйӘӨв‘Өдёӯзҡ„вҖңдёҖзі»еҲ—ж“ҚдҪңвҖқеҢ…жӢ¬иҝҮж»ӨгҖҒжҙ—ж¶ӨгҖҒеҗҲ并ж»Өж¶Іе’Ңжҙ—ж¶Өж¶ІгҖҒзӯүж“ҚдҪңпјҺ
-
пјҲ6пјү дёүйўҲзғ§з“¶еҠ е…Ҙ
 зўҳеҚ•иҙЁпјҢиӢҘжңҹжңӣеҸҚеә”зҡ„дә§зҺҮдёә88%еҲҷжңҖз»Ҳеҫ—еҲ°дә§е“Ғзҡ„иҙЁйҮҸдёәпјҺ
зўҳеҚ•иҙЁпјҢиӢҘжңҹжңӣеҸҚеә”зҡ„дә§зҺҮдёә88%еҲҷжңҖз»Ҳеҫ—еҲ°дә§е“Ғзҡ„иҙЁйҮҸдёәпјҺ
 CO32-+H3O+
B . з”Ёй«ҳй”°й…ёй’ҫж ҮеҮҶжә¶ж¶Іж»ҙе®ҡиҚүй…ёпјҡ2MnO4-+6H++5H2C2O4=2Mn2++10CO2вҶ‘+8H2O
C . з”Ёзўій…ёж°ўй’ жә¶ж¶ІжЈҖйӘҢж°ҙжқЁй…ёдёӯзҡ„зҫ§еҹәпјҡ
CO32-+H3O+
B . з”Ёй«ҳй”°й…ёй’ҫж ҮеҮҶжә¶ж¶Іж»ҙе®ҡиҚүй…ёпјҡ2MnO4-+6H++5H2C2O4=2Mn2++10CO2вҶ‘+8H2O
C . з”Ёзўій…ёж°ўй’ жә¶ж¶ІжЈҖйӘҢж°ҙжқЁй…ёдёӯзҡ„зҫ§еҹәпјҡ  +2HCO3-вҶ’
+2HCO3-вҶ’  +2H2O+2CO2вҶ‘
D . еҗ‘Na2SiO3жә¶ж¶Ідёӯж»ҙеҠ зЁҖзӣҗй…ёпјҡNa2SiO+2H+=H2SiO3вҶ“+2Na+
+2H2O+2CO2вҶ‘
D . еҗ‘Na2SiO3жә¶ж¶Ідёӯж»ҙеҠ зЁҖзӣҗй…ёпјҡNa2SiO+2H+=H2SiO3вҶ“+2Na+
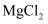 жә¶ж¶Іпјҡ
жә¶ж¶Іпјҡ  B . дҪҝз”Ё
B . дҪҝз”Ё 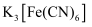 жЈҖйӘҢ
жЈҖйӘҢ  C . жіЎжІ«зҒӯзҒ«еҷЁе·ҘдҪңеҺҹзҗҶпјҡ
C . жіЎжІ«зҒӯзҒ«еҷЁе·ҘдҪңеҺҹзҗҶпјҡ  D .
D .  еңЁж°ҙдёӯеҸ‘з”ҹж°ҙи§Јпјҡ
еңЁж°ҙдёӯеҸ‘з”ҹж°ҙи§Јпјҡ 
 гҖҒCl-
B . дёҺAlеҸҚеә”иғҪж”ҫеҮәH2зҡ„жә¶ж¶ІдёӯпјҡFe2+гҖҒK+гҖҒ
гҖҒCl-
B . дёҺAlеҸҚеә”иғҪж”ҫеҮәH2зҡ„жә¶ж¶ІдёӯпјҡFe2+гҖҒK+гҖҒ  гҖҒ
гҖҒ  C .
C .  =1Г—10-13mol/Lзҡ„жә¶ж¶Ідёӯпјҡ
=1Г—10-13mol/Lзҡ„жә¶ж¶Ідёӯпјҡ  гҖҒCa2+гҖҒCl-гҖҒ
гҖҒCa2+гҖҒCl-гҖҒ  D . ж°ҙз”өзҰ»зҡ„c(H+)=1Г—10-13mol/Lзҡ„жә¶ж¶ІдёӯпјҡK+гҖҒNa+гҖҒ
D . ж°ҙз”өзҰ»зҡ„c(H+)=1Г—10-13mol/Lзҡ„жә¶ж¶ІдёӯпјҡK+гҖҒNa+гҖҒ  гҖҒ
гҖҒ 
иҜ·еӣһзӯ”дёӢеҲ—й—®йўҳпјҡ
-
пјҲ1пјү иғҪеҜјз”өзҡ„жҳҜ (еЎ«еәҸеҸ·пјҢдёӢеҗҢ)гҖӮ
-
пјҲ2пјү еұһдәҺз”өи§ЈиҙЁзҡ„жҳҜ
-
пјҲ3пјү еұһдәҺйқһз”өи§ЈиҙЁзҡ„жҳҜ гҖӮ
-
пјҲ4пјү NaHSO4жҳҜдёҖз§Қй…ёејҸзӣҗпјҢеҸҜз”ЁдҪңжё…жҙҒеүӮгҖҒйҳІи…җеүӮзӯүгҖӮ
в‘ NaHSO4жә¶дәҺж°ҙж—¶зҡ„з”өзҰ»ж–№зЁӢејҸдёә гҖӮ
в‘Ўеҗ‘Ba(OH)2жә¶ж¶Ідёӯж»ҙеҠ NaHSO4жә¶ж¶ІпјҢжҒ°еҘҪдҪҝBa2+жІүж·Җе®Ңе…ЁпјҢеҸҚеә”зҡ„зҰ»еӯҗж–№зЁӢејҸдёәгҖӮиӢҘеҗ‘еҸҚеә”еҗҺзҡ„дёҠеұӮжё…ж¶Ідёӯ继з»ӯж»ҙеҠ NaHSO4жә¶ж¶ІпјҢеҸҚеә”зҡ„еҢ–еӯҰж–№зЁӢејҸдёәгҖӮ
 пјқ3Fe3+ пјӢNOвҶ‘пјӢ4H2O
B . CaпјҲHCO3пјү2 жә¶ж¶ІдёӯеҠ е…Ҙе°‘йҮҸ NaOH жә¶ж¶ІпјҡCa2пјӢпјӢ2HCO
пјқ3Fe3+ пјӢNOвҶ‘пјӢ4H2O
B . CaпјҲHCO3пјү2 жә¶ж¶ІдёӯеҠ е…Ҙе°‘йҮҸ NaOH жә¶ж¶ІпјҡCa2пјӢпјӢ2HCO  пјӢ2OHпјҚпјқCaCO3вҶ“пјӢCO
пјӢ2OHпјҚпјқCaCO3вҶ“пјӢCO  пјӢH2O
C . жҳҺзҹҫжә¶ж¶ІдёӯеҠ е…Ҙ BaпјҲOHпјү2 жә¶ж¶ІиҮіз”ҹжҲҗжІүж·Җзү©иҙЁзҡ„йҮҸжңҖеӨҡпјҡAl3пјӢпјӢ2SO
пјӢH2O
C . жҳҺзҹҫжә¶ж¶ІдёӯеҠ е…Ҙ BaпјҲOHпјү2 жә¶ж¶ІиҮіз”ҹжҲҗжІүж·Җзү©иҙЁзҡ„йҮҸжңҖеӨҡпјҡAl3пјӢпјӢ2SO  пјӢ2Ba2пјӢпјӢ4OHпјҚпјқAlO
пјӢ2Ba2пјӢпјӢ4OHпјҚпјқAlO  пјӢ2BaSO4вҶ“пјӢ2H2O
D . з”Ё Na2SO3 жә¶ж¶Іеҗёж”¶е°‘йҮҸ Cl2пјҡ3 SO
пјӢ2BaSO4вҶ“пјӢ2H2O
D . з”Ё Na2SO3 жә¶ж¶Іеҗёж”¶е°‘йҮҸ Cl2пјҡ3 SO  +Cl2+H2O = 2 HSO
+Cl2+H2O = 2 HSO  +2Cl -+SO
+2Cl -+SO 
|
ејұз”өи§ЈиҙЁ |
CH3COOH |
NH3вҖўH2O |
H2CO3 |
H2C2O4 |
|
KaжҲ–Kb |
1.8Г—10-5 |
1.8Г—10-5 |
Ka1=4.3Г—10-7 |
Ka1=5.6Г—10-2 Ka2=5.0Г—10-5 |
еӣһзӯ”дёӢеҲ—жңүе…іе°Ҹйўҳпјҡ
-
пјҲ1пјү еҶҷеҮәNaHCO3зҡ„з”өзҰ»ж–№зЁӢејҸпјӣеҲ—еҮәNH
 зҡ„ж°ҙи§Је№іиЎЎеёёж•°иЎЁиҫҫејҸKh(NH
зҡ„ж°ҙи§Је№іиЎЎеёёж•°иЎЁиҫҫејҸKh(NH  )=пјҢи®Ўз®—еёёжё©дёӢKh(NH
)=пјҢи®Ўз®—еёёжё©дёӢKh(NH  )=гҖӮ
)=гҖӮ
-
пјҲ2пјү в‘Ўдёӯеҗ„зҰ»еӯҗжө“еәҰз”ұеӨ§еҲ°е°Ҹзҡ„йЎәеәҸдёәгҖӮ
-
пјҲ3пјү еёёжё©дёӢпјҡиӢҘе°Ҷв‘Је’Ңв‘Ҙж··еҗҲпјҢ并дҪҝж··еҗҲеҗҺжә¶ж¶ІpH=7пјҢеҲҷжүҖйңҖдҪ“з§ҜVв‘ЈVв‘Ҙ(еЎ«вҖң>вҖқвҖң<вҖқжҲ–вҖң=вҖқ)пјӣиӢҘе°Ҷв‘Је’Ңв‘Ұж··еҗҲпјҢ并дҪҝж··еҗҲеҗҺжә¶ж¶ІpH=12пјҢеҲҷVв‘ЈпјҡVв‘Ұ=пјӣе°Ҷв‘Је’Ңв‘ҰзӯүдҪ“з§Ҝж··еҗҲеҫ—wжә¶ж¶ІпјҢв‘Өе’Ңв‘ҘзӯүдҪ“з§Ҝж··еҗҲеҫ—Zжә¶ж¶ІпјҢж··еҗҲеҗҺжә¶ж¶ІpHеҖјWZ(еЎ«вҖң>вҖқгҖҒвҖң<вҖқжҲ–вҖң=вҖқпјҢдёӢеҗҢ)пјӣ
-
пјҲ4пјү ⑧е’Ңв‘Ёж··еҗҲеҰӮжһңиғҪеҸҚеә”пјҢеҶҷеҮәзҰ»еӯҗеҸҚеә”ж–№зЁӢејҸпјҢеҰӮжһңдёҚиғҪеҸҚеә”пјҢеҲҷиҜҘе°ҸйўҳдёҚеЎ«гҖӮ
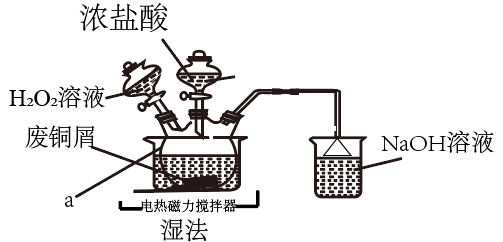
ж°ҜеҢ–й“ңеңЁдёҚеҗҢжё©еәҰдёӢз»“жҷ¶еҪўжҲҗзҡ„з»“жҷ¶ж°ҙеҗҲзү©
жё©еәҰ |
|
|
|
|
з»“жҷ¶ж°ҙеҗҲзү© |
|
|
|
|
еӣһзӯ”дёӢеҲ—й—®йўҳпјҡ
-
пјҲ1пјү д»ӘеҷЁ
 зҡ„еҗҚз§°дёәпјҢ
зҡ„еҗҚз§°дёәпјҢ жә¶ж¶Ізҡ„дҪңз”ЁжҳҜгҖӮ
жә¶ж¶Ізҡ„дҪңз”ЁжҳҜгҖӮ
-
пјҲ2пјү вҖңж№ҝжі•вҖқеҲ¶еӨҮ
 зҡ„зҰ»еӯҗж–№зЁӢејҸдёәпјҢе®һйӘҢдёӯпјҢ
зҡ„зҰ»еӯҗж–№зЁӢејҸдёәпјҢе®һйӘҢдёӯпјҢ зҡ„е®һйҷ…з”ЁйҮҸиҰҒеӨ§дәҺзҗҶи®әз”ЁйҮҸпјҢеҺҹеӣ жҳҜгҖӮ
зҡ„е®һйҷ…з”ЁйҮҸиҰҒеӨ§дәҺзҗҶи®әз”ЁйҮҸпјҢеҺҹеӣ жҳҜгҖӮ
-
пјҲ3пјү дёәеҫ—еҲ°зәҜеҮҖзҡ„
 жҷ¶дҪ“пјҢеҸҚеә”е®Ңе…ЁеҗҺиҰҒиҝӣиЎҢзҡ„ж“ҚдҪңжҳҜпјҡйҷӨеҺ»е…¶д»–еҸҜиғҪзҡ„йҮ‘еұһзҰ»еӯҗеҗҺпјҢиҝҮж»ӨпјҢеҗ‘ж»Өж¶ІдёӯжҢҒз»ӯйҖҡе…Ҙ
жҷ¶дҪ“пјҢеҸҚеә”е®Ңе…ЁеҗҺиҰҒиҝӣиЎҢзҡ„ж“ҚдҪңжҳҜпјҡйҷӨеҺ»е…¶д»–еҸҜиғҪзҡ„йҮ‘еұһзҰ»еӯҗеҗҺпјҢиҝҮж»ӨпјҢеҗ‘ж»Өж¶ІдёӯжҢҒз»ӯйҖҡе…Ҙ ж°”дҪ“пјҢеҠ зғӯи’ёеҸ‘жө“зј©пјҢпјҢиҝҮж»ӨпјҢжҙ—ж¶ӨпјҢдҪҺжё©е№ІзҮҘгҖӮе…¶дёӯпјҢжҢҒз»ӯйҖҡе…Ҙ
ж°”дҪ“пјҢеҠ зғӯи’ёеҸ‘жө“зј©пјҢпјҢиҝҮж»ӨпјҢжҙ—ж¶ӨпјҢдҪҺжё©е№ІзҮҘгҖӮе…¶дёӯпјҢжҢҒз»ӯйҖҡе…Ҙ зҡ„дҪңз”ЁжҳҜгҖӮ
зҡ„дҪңз”ЁжҳҜгҖӮ
-
пјҲ4пјү з”ЁвҖңй—ҙжҺҘзўҳйҮҸжі•вҖқжөӢе®ҡ
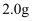 еәҹй“ңеұ‘зҡ„еҲ©з”ЁзҺҮгҖӮеҸ–жүҖеҫ—иҜ•ж ·жә¶дәҺж°ҙй…ҚжҲҗ
еәҹй“ңеұ‘зҡ„еҲ©з”ЁзҺҮгҖӮеҸ–жүҖеҫ—иҜ•ж ·жә¶дәҺж°ҙй…ҚжҲҗ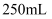 пјҢ еҸ–еҮә
пјҢ еҸ–еҮә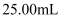 пјҢ еҗ‘е…¶дёӯеҠ е…ҘиҝҮйҮҸ
пјҢ еҗ‘е…¶дёӯеҠ е…ҘиҝҮйҮҸ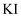 еӣәдҪ“пјҢе……еҲҶеҸҚеә”пјҢз”ҹжҲҗзҷҪиүІ
еӣәдҪ“пјҢе……еҲҶеҸҚеә”пјҢз”ҹжҲҗзҷҪиүІ жІүж·ҖпјҢж»ҙе…ҘеҮ ж»ҙж·ҖзІүжә¶ж¶ІдҪңжҢҮзӨәеүӮпјҢз”Ё
жІүж·ҖпјҢж»ҙе…ҘеҮ ж»ҙж·ҖзІүжә¶ж¶ІдҪңжҢҮзӨәеүӮпјҢз”Ё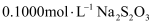 ж ҮеҮҶжә¶ж¶Іж»ҙе®ҡпјҢеҲ°иҫҫж»ҙе®ҡз»ҲзӮ№ж—¶пјҢж¶ҲиҖ—
ж ҮеҮҶжә¶ж¶Іж»ҙе®ҡпјҢеҲ°иҫҫж»ҙе®ҡз»ҲзӮ№ж—¶пјҢж¶ҲиҖ— ж ҮеҮҶжә¶ж¶І
ж ҮеҮҶжә¶ж¶І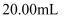 гҖӮ(ж¶үеҸҠеҲ°зҡ„еҸҚеә”дёәпјҡ
гҖӮ(ж¶үеҸҠеҲ°зҡ„еҸҚеә”дёәпјҡ пјҢ
пјҢ 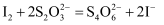 )
)в‘ ж»ҙе®ҡз»ҲзӮ№зҡ„еҲӨж–ӯпјҡеҪ“ж»ҙе…ҘжңҖеҗҺдёҖж»ҙж ҮеҮҶж¶ІпјҢжә¶ж¶ІжҒ°еҘҪ(еЎ«йўңиүІеҸҳеҢ–)пјҢдё”еҚҠеҲҶй’ҹдёҚеҶҚеҸ‘з”ҹеҸҳеҢ–гҖӮ
в‘Ўеәҹй“ңеұ‘дёӯй“ңзҡ„зҷҫеҲҶеҗ«йҮҸдёәгҖӮ
-
пјҲ5пјү жҹҘйҳ…иө„ж–ҷпјҡ
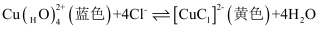 пјҢ зӯүйҮҸй»„иүІдёҺи“қиүІж··еҗҲе‘Ҳз»ҝиүІгҖӮи®ҫи®Ўе®һйӘҢиҜҒжҳҺ
пјҢ зӯүйҮҸй»„иүІдёҺи“қиүІж··еҗҲе‘Ҳз»ҝиүІгҖӮи®ҫи®Ўе®һйӘҢиҜҒжҳҺ жә¶ж¶ІдёӯеӯҳеңЁдёҠиҝ°е№іиЎЎпјӣеҸ–е°‘йҮҸи“қиүІ
жә¶ж¶ІдёӯеӯҳеңЁдёҠиҝ°е№іиЎЎпјӣеҸ–е°‘йҮҸи“қиүІ зЁҖжә¶ж¶ІдәҺиҜ•з®ЎдёӯпјҢгҖӮ
зЁҖжә¶ж¶ІдәҺиҜ•з®ЎдёӯпјҢгҖӮ
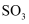 B .
B .  C . Fe
D .
C . Fe
D . 
йҖүйЎ№ | е®һйӘҢж“ҚдҪң | и§ЈйҮҠжҲ–з»“и®ә |
A | е°Ҷеҗ«жңүдәҢж°§еҢ–зЎ«зҡ„ж°”дҪ“йҖҡе…Ҙй…ёжҖ§й«ҳй”°й…ёй’ҫдёӯпјҢ然еҗҺеҠ е…Ҙи¶ійҮҸж°ҜеҢ–й’Ўжә¶ж¶І | йҖҡиҝҮжөӢе®ҡзҷҪиүІжІүж·Җзҡ„иҙЁйҮҸпјҢеҸҜжҺЁз®—дәҢж°§еҢ–зЎ«зҡ„зү©иҙЁзҡ„йҮҸ |
B | е®һйӘҢе®Өз”Ёжө“зЎ«й…ёе’Ңд№ҷйҶҮеҲ¶еҸ–д№ҷзғҜж—¶пјҢиӢҘиҰҒжЈҖйӘҢжүҖеҫ—ж°”дҪ“еҗ«жңүCH2=CH2 пјҢ еҸҜе°Ҷж··еҗҲж°”дҪ“е№ІзҮҘеҗҺпјҢйҖҡе…Ҙжәҙзҡ„еӣӣж°ҜеҢ–зўіжә¶ж¶Ідёӯ | иӢҘжә¶ж¶ІиӨӘиүІпјҢеҲҷиҜҒжҳҺжңүд№ҷзғҜ |
C | еёёжё©дёӢпјҢз”ЁpHи®ЎеҲҶеҲ«жөӢе®ҡзӯүдҪ“з§Ҝ1mol/L CH3COONH4жә¶ж¶Іе’Ң0.1mol/L CH3COONH4жә¶ж¶Ізҡ„pHпјҢжөӢеҫ—pHйғҪзӯүдәҺ7 | еҗҢжё©дёӢпјҢдёҚеҗҢжө“еәҰзҡ„CH3COONH4жә¶ж¶Ідёӯж°ҙзҡ„з”өзҰ»зЁӢеәҰзӣёеҗҢ |
D | жҺўз©¶жө“еәҰеҜ№еҸҚеә”йҖҹзҺҮзҡ„еҪұе“ҚпјҢеҗ‘2ж”Ҝзӣӣжңү5mLдёҚеҗҢжө“еәҰNaHSO3жә¶ж¶Ізҡ„иҜ•з®ЎдёӯеҗҢж—¶еҠ е…Ҙ2mL 5% H2O2жә¶ж¶ІпјҢи§ӮеҜҹзҺ°иұЎ | жҺўз©¶жө“еәҰеҜ№еҸҚеә”йҖҹзҺҮзҡ„еҪұе“Қ |
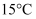 д»ҘдёӢ
д»ҘдёӢ
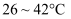
 д»ҘдёҠ
д»ҘдёҠ