第一节 金属的化学性质 知识点题库
①立即有大量气泡生成.
②无色透明的酚酞溶液迅速变红,振荡后,溶液中的红色褪去,又变为无色.
③反应放出大量的热量,试管壁手触感觉很烫.
请回答:
(1)该兴趣小组同学认为酚酞试液颜色变化的为:
假设①: .
假设②:可能是反应放出的热量,使红色消失.
假设③:可能是Na2O2与水反应生成的NaOH溶液浓度太大,使得酚酞变性,不显颜色.
(2)验证假设②,设计补充实验:取滴加酚酞的稀NaOH溶液加热,若红色消失,则证明假设②成立;若红色不消失,则假设②不成立.
(3)验证假设③,设计补充实验: .
选项 | 实验现象 | 结论 |
A | 把相同大小的一块铝和镁分别投入相同浓度的NaOH溶液中:铝溶解有气泡放出,而镁没有任何变化 | 由此得出:铝的金属性比镁强 |
B | 取一块铝箔,用酒精灯点燃:铝箔只熔化成液体而没有脱落 | 由此得出:铝不易燃烧 |
C | 向氯化铵溶液中投入一铝片:铝片上产生大量气泡 | 由此得出:该气体是氨气 |
D | 向氯化铝溶液中逐滴滴加NaOH溶液至过量:先产生白色沉淀,后沉淀逐渐溶解,最后沉淀完全消失 | 由此得出:氢氧化铝能溶于强碱溶液 |
①钠在空气中燃烧生成白色的氧化钠
②钠投入硫酸铜溶液中有红色粉末产生
③过氧化钠可在防毒面具中做供氧剂
④铁丝在氯气中燃烧生成红棕色的FeCl3 .
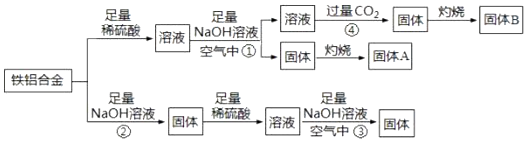
-
(1) 铁铝合金是一种高电磁性能合金,下列有关推测可能正确的是_____(填序号).A . 铁铝合金可由铁和铝熔融混合制成 B . 铁铝合金的熔点高于铝和铁 C . 铁铝合金硬度高于纯铝
-
(2) 反应①中铝元素发生反应的离子方程式为.
-
(3) 反应②的化学方程式为.
-
(4) 反应③发生时观察到的现象是.
-
(5) 反应④中的CO2不宜换成HCl,原因是.
-
(6) 请分别举出固体A和B的一种用途、.
实验现象 | 解释与结论 |
⑴ | 密度比水小 |
⑵熔化成闪亮的小球 | |
⑶四处游动、嘶嘶作响 | |
⑷反应后溶液呈红色 |
⑸钠与水反应方程式是。实验室中金属钠通常保存在。
⑹实验室常用氢氧化钠溶液来吸收多余的氯气以防止污染空气,请写出发生反应的方程式。漂白粉长时期露置在空气中会失效,用方程式表示其失效的原因;。
 溶液中,第二份加入足量的盐酸中,若两份铝粉放出
溶液中,第二份加入足量的盐酸中,若两份铝粉放出  的体积相同(同温同压),则两份铝粉的质量比为
的体积相同(同温同压),则两份铝粉的质量比为
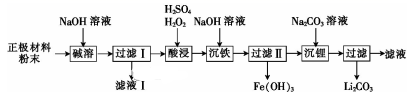
已知LiFePO4不溶于水和碱,能溶于强酸。
-
(1) “碱溶”时的离子方程式为。
-
(2) 向滤液Ⅰ中通入过量CO2会析出Al(OH)3沉淀,写出该反应的离子方程式:。
-
(3) “酸浸”时溶液中Fe2+发生反应的离子方程式为。
-
(4) 检验“沉铁”后所得溶液中是否存在Fe3+的方法是。
-
(5) 以Fe(OH)3为原料可以制取FeSO4晶体,还需的试剂有。
-
(6) “沉锂”时,检验Li+是否沉淀完全的方法是。
-
(1) 电子工业用FeCl3溶液腐蚀敷在绝缘板上的铜,制造印刷电路板,请写出FeCl3溶液与铜反应的离子方程式:。
-
(2) 甲、乙两位同学用如下实验探究Fe2+、Fe3+的性质。回答下列问题:
①甲同学取2 mL FeCl2溶液,加入几滴氯水,再加入1滴KSCN溶液,溶液变红,说明Cl2可将FeCl2氧化。FeCl2溶液与氯水反应的化学方程式为。
②乙同学认为甲的实验不够严谨,该同学在2 mL FeCl2溶液中先加入0.5 mL煤油,再于液面下依次加入几滴氯水和1滴KSCN溶液,溶液变红,煤油的作用是。
-
(3) 如图所示装置可用来制取和观察氢氧化亚铁在空气中被氧化时颜色的变化。实验时必须使用铁屑和6 mol/L的硫酸,其他试剂任选。

①实验开始时就先将止水夹E
 填“打开”或“关闭”
填“打开”或“关闭”  。
。②待装置B中出现较多白色沉淀时,拔去装置B中的橡皮塞,使空气进入,请写出白色沉淀变为红褐色沉淀的化学方程式。
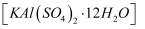 既可用作净水剂,也可用作消毒剂
C . 青铜是我国使用最早的合金,钢是用量最大、用途最广的合金
D . 铁在潮湿的空气中生成的氧化物疏松多孔,不能保护内层金属
既可用作净水剂,也可用作消毒剂
C . 青铜是我国使用最早的合金,钢是用量最大、用途最广的合金
D . 铁在潮湿的空气中生成的氧化物疏松多孔,不能保护内层金属



