第一节 金属的化学性质 知识点题库
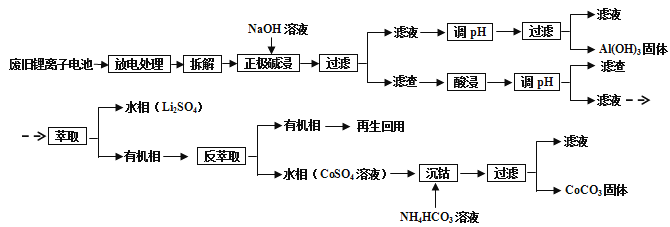
锂离子电池的应用很广,其正极材料可再生利用.某离子电池正极材料有钴酸锂(LiCoO2),导电剂乙炔黑和铝箔等.充电时,该锂离子电池负极发生的反应为6C+xLi++xe﹣═LixC6 . 现欲利用以下工艺流程回收正极材料中的某些金属资源(部分条件未给出).
-
(1) LiCoO2中,Co元素的化合价为
-
(2) 写出“正极碱浸”中发生反应的离子方程式
-
(3) “酸浸”一般在80℃下进行,写出该步骤中发生的所有氧化还原反应的化学方程式 可用盐酸代替H2SO4和H2O2的混合液,但缺点是
-
(4) 写出“沉钴”过程中发生反应的化学方程式
-
(5) 充放电过程中,发生LiCoO2与Li1﹣xCoO2之间的转化,写出放电时电池反应方程式
 Fe2O3+3H2
D . 钠投入到水中,产生气体:2Na+2H2O═2NaOH+H2↑
Fe2O3+3H2
D . 钠投入到水中,产生气体:2Na+2H2O═2NaOH+H2↑
-
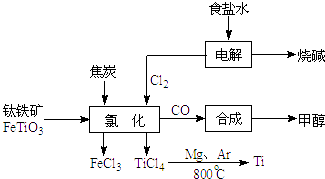
(1) 电解饱和食盐水时,总反应的离子方程式是.
-
(2) 根据上面流程写出钛铁矿经氯化法得到四氯化钛的化学方程式.
-
(3) 已知:①Mg(s)+Cl2(g)=MgCl2(s)△H=﹣641kJ•mol﹣1
②Ti(s)+2Cl2(g)=TiCl4(s)△H=﹣770kJ•mol﹣1则2Mg(s)+TiCl4(s)=2MgCl2(s)+Ti(s)△H=.反应2Mg(s)+TiCl4(s)
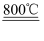 2MgCl2(s)+Ti,在Ar气氛中进行的理由是:.
2MgCl2(s)+Ti,在Ar气氛中进行的理由是:. -
(4) 以甲醇、空气、氢氧化钾溶液为原料,石墨为电极可构成燃料电池.该电池中负极上的电极反应式是
-
(1) 写出下列物质的化学式:生石灰;熟石灰.
-
(2) 写出下列反应的化学方程式:
①Na2CO3溶液中通入C02
②氯碱工业中用烧碱处理尾气
③金属钠与水反应.
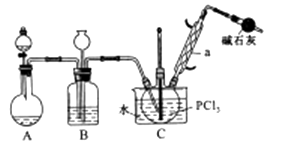
有关物质的部分性质如下表:
熔点/℃ | 沸点/℃ | 其他 | |
PCl3 | -112 | 75.5 | 遇水生成H3PO3和HCl,遇O2生成POCl3 |
POCl3 | 2 | 105.3 | 遇水生成H3PO4和HCl,能溶于PCl3 |
回答下列问题:
-
(1) 仪器a的名称是,装置A中发生反应的化学方程式为。
-
(2) B装置的作用除观察O2的流速之外。还有。
-
(3) C装置控制反应在60℃~65℃进行,其主要目的是。
-
(4) 通过佛尔哈德法可以测定三氯氧磷产品中Cl元素含量,实验步骤如下:
I.取xg产品于锥形瓶中,加入足量NaOH溶液,待完全反应后加稀硝酸至酸性。
II.向锥形瓶中加入0.1000mol/L的AgNO3溶液 40.00 mL,使 Cl-完全沉淀。
III.向其中加入2mL硝基苯,用力摇动,使沉淀表面被有机物覆盖。
IV.加入指示剂,用cmol/LNH4SCN溶液滴定过量Ag+至终点,记下所用体积VmL。
已知:Ksp(AgCl)=3.2×10-10 , Ksp(AgSCN)=2×10-12
①滴定选用的指示剂是(填标号),滴定終点的现象为。
a.FeCl2
b.NH4Fe(SO4)2
c.淀粉
d.甲基橙
②Cl元素的质量百分含量为(列出算式)。
③步骤III加入硝基苯的目的是,如无此操作,所测Cl元素含量将会(填“偏大”“偏小”或“不变”)。
①金属钠投入到FeCl3溶液中 ②过量NaOH溶液和明矾溶液混合
③少量Ca(OH)2投入过量NaHCO3溶液中 ④足量Na2O2投入FeCl2溶液中
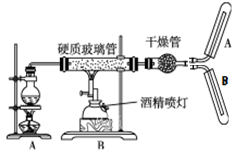
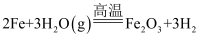 C . 干燥管中加入的固体干燥剂可以是无水硫酸铜
D . 收集反应产生的气体选用装置A
C . 干燥管中加入的固体干燥剂可以是无水硫酸铜
D . 收集反应产生的气体选用装置A
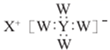 。下列说法错误的是( )
。下列说法错误的是( )
-
(1) ①写出小苏打的化学名称;②写出漂白液有效成分的化学式。
-
(2) 写出高温下Fe与水蒸气反应的化学方程式。
-
(3) 写出过氧化钠与水反应的化学方程式。
| ① | ② | ③ | ④ | |||
| ⑤ | ⑥ | ⑦ |
已知:⑤的焰色试验火焰呈黄色.
请填写下列空白:
-
(1) ②在元素周期表中的位置为;①的原子结构示意图为;③的核电荷数为.
-
(2) ③的一种核素的中子数为10,其原子符号为(用
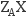 形式表示).
形式表示).
-
(3) ④和⑦中非金属性较弱的是(填元素符号,下同),氢化物稳定性较强的是.
-
(4) ①和⑤中原子半径较大的是(填元素符号),⑤和③的最简单氢化物反应的离子方程式为.
-
(5) 将⑥加入⑤的最高价氧化物对应水化物的溶液中,发生反应的离子方程式为.
①钠与水反应时浮于水面且呈小球状游动
②钠着火时用干燥的沙土灭火
③钠元素在自然界中的存在形式既有游离态又有化合态
④钠可从硫酸亚铁溶液中置换出铁
⑤金属钠既有还原性又有氧化性



