第一节 金属的化学性质 知识点题库
取等物质的量的镁粉和铝粉混合,再将混合物平均分为四份,分别加入足量的下列溶液中,充分反应后放出氢气最多的是( )
A . 3mol/L的HCl
B . 4mol/L的HNO3
C . 8mol/L的NaOH
D . 18mol/L的H2SO4
实验题
-
(1) 分别取Wg钠、铁、铝与足量的盐酸反应,在相同条件下产生氢气的体积比是。
-
(2) 分别取0.1mol钠、铁、铝与足量的盐酸反应,在相同条件下产生氢气的体积比是。
-
(3) 若产生相同物质的量的氢气,所需钠、铁、铝的质量比是。
-
(4) 若产生相同体积(同温同压)的氢气,所需钠、铁、铝三种金属的物质的量之比是。
将物质的量均为0.1mol AlCl3、K2SO4和Al2(SO4)3溶于水,向其中加入一定量的Ba(OH)2溶液,测得溶液与沉淀中均含有铝元素,则生成BaSO4的物质的量不可能为( )
A . 0.2mol
B . 0.25 mol
C . 0.35 mol
D . 0.45 mol
下列关于铁及其化合物的说法正确的是( )
A . 将Fe(NO3)2样品溶于稀H2SO4后,滴加KSCN溶液,观察溶液是否变红,可以检验Fe(NO3)2晶体是否已氧化变质
B . 浓氨水中滴加FeCl3饱和溶液可制得Fe(OH)3胶体
C . 1 mol FeI2与足量氯气反应时转移的电子数为2NA
D . 水溶液中Fe2+、H+、SO  、ClO﹣不能大量共存
、ClO﹣不能大量共存
 、ClO﹣不能大量共存
、ClO﹣不能大量共存
下列实验现象与对应结论均正确的是( )
选项 | 操作 | 现象 | 结论 |
A | KI淀粉溶液中滴入氯水,再通入SO2 | 先变蓝色后褪色 | SO2有漂白性 |
B | 用洁净铂丝蘸取无色溶液进行焰色反应 | 火焰呈黄色 | 无色溶液为钠盐溶液 |
C | 向白色ZnS沉淀上滴加0.1mol/LCuSO4溶液 | 沉淀变为黑色 | Ksp(ZnS)>Ksp(CuS) |
D | 常温下将Al片放入浓硝酸中 | 无明显变化 | Al与浓硝酸不反应 |
A . A
B . B
C . C
D . D
根据题意填空:
-
(1) Ⅰ污水经过一级、二级处理后,还含有少量Cu2+、Hg2+、Pb2+等重金属离子,可加入沉淀剂使其沉淀.下列物质不能作为沉淀剂的是
A.氨水 B.硫化氢气体
C.硫酸钠溶液 D.纯碱溶液
Ⅱ合成氨的流程示意图如下:
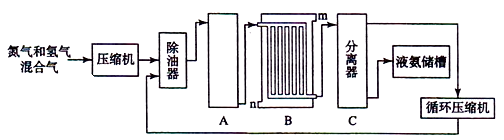
回答下列问题:
工业合成氨的原料是氮气和氢气.氮气是从空气中分离出来的,通常使用的两种分离方法是,;氢气的来源是水和碳氢化合物,写出分别采用煤和天然气为原料制取氢气的化学反应方程式,;
-
(2) 设备A中含有电加热器、触煤和热交换器,设备A的名称,其中发生的化学反应方程式为;
-
(3) 设备B的名称,其中m和n是两个通水口,入水口是(填“m”或“n”).不宜从相反方向通水的原因;
-
(4) 设备C的作用;
-
(5) 在原料气制备过程中混有CO对催化剂有毒害作用,欲除去原料气中的CO,可通过如下反应来实现:
CO(g)+H2O(g)⇌CO2 (g)+H2 (g)
已知1000K时该反应的平衡常数K=0.627,若要使CO的转化超过90%,则起始物中c(H2O):c(CO)不低于.
把铁片放入下列溶液中,铁片溶解,溶液质量增加,但没有气体放出的是( )
A . 稀H2SO4
B . CuSO4溶液
C . AgNO3溶液
D . Fe2(SO4)3溶液
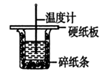
分别完成实验:a.红磷转变为白磷;b.钠与氧气加热反应.
现在如图所示三套硬质试管可供选择:(固定装置铁架台和热源酒精灯已省略):
![]()
-
(1) 请简述从试剂瓶中取出一小块钠的操作过程
-
(2) 实验a采用 装置,实验b采用 装置.(添相应序号)
请简述选择相应装置的理由
-
(3) 如何用化学方法证明钠与氧气反应生成了Na2O2 , 请简述实验方法:取少量反应后冷却的固体放入试管中,然后.
某同学将一块铝箔用砂纸仔细打磨,除去表面的保护膜,用坩埚钳夹住放在酒精灯火焰上加热,观察到的现象是( )
A . 剧烈燃烧
B . 发出耀眼白光
C . 熔化的铝滴落
D . 失去金属光泽
钠作为一种重要原料,可用于制造许多在国防工业上有重要用途的金属。下列关于钠的说法错误的是( )
A . 银白色固体
B . 密度比水大
C . 能与水剧烈反应
D . 可保存在煤油中
将一小块金属钠长期露置于空气中发生一系列变化,最终产物是( )
A . Na2CO3
B . Na2O
C . NaOH
D . Na2O2
某工厂的工业废水中含有大量的FeSO4、较多的Cu2+和少量的Na+.为了减少污染并变废为宝,工厂计划从该废水中回收硫酸亚铁和金属铜.请根据流程图,填写物质名称(或主要成分的化学式)或操作方法,完成回收硫酸亚铁和铜的简单实验方案.
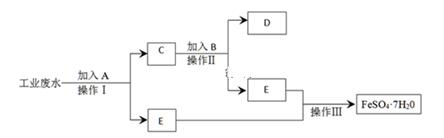
-
(1) A,B,D分别为、、。
-
(2) 操作Ⅱ、操作Ⅲ分别是、。
为探究某固体氧化物A(仅含两种元素)的组成和性质,设计并完成如下实验。请回答:
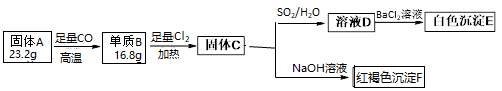
-
(1) 固体A的化学式。
-
(2) 单质B在氯气中反应的现象。
-
(3) 写出C→D在溶液中发生氧化还原反应的离子方程式。
-
(1) 在一个充满CO2的铝制易拉罐中加入适量的NaOH溶液,并密封,易拉罐会慢慢变瘪,原因是(用化学方程式表示,下同)后又慢慢鼓起来,原因是。
-
(2) 写出还原铁粉与水蒸气反应的化学方程式。
-
(3) 实验室用碳酸钙与盐酸反应制取CO2气体,反应的离子方程式:;常用澄清石灰水检验CO2气体的离子方程式是。将表面附有铁锈(成分是Fe2O3)的铁钉放入稀硫酸中,开始反应的离子方程式是;反应片刻后,可观察到有气体产生,其离子方程式是。
-
(4) 人体胃液中有胃酸(0.2%~0.4%的盐酸),起杀菌、帮助消化等作用,但胃酸的量不能过多或过少,它必须控制在一定范围内,当胃酸过多时,医生通常用“小苏打片”或“胃舒平”给病人治疗。
①用小苏打片(NaHCO3)治疗胃酸过多的离子方程式为。
②如果病人同时患有胃溃疡,此时最好服用胃舒平[主要成分是Al(OH)3],反应的离子方程式为。
下列说法错误的是( )
A .  会破坏铝表面的氧化膜
B .
会破坏铝表面的氧化膜
B .  的热稳定性比
的热稳定性比  强
C .
强
C .  具有氧化性,其稀溶液可用于消毒
D . 钢铁在潮湿空气中生锈主要是发生了电化学腐蚀
具有氧化性,其稀溶液可用于消毒
D . 钢铁在潮湿空气中生锈主要是发生了电化学腐蚀
 会破坏铝表面的氧化膜
B .
会破坏铝表面的氧化膜
B .  的热稳定性比
的热稳定性比  强
C .
强
C .  具有氧化性,其稀溶液可用于消毒
D . 钢铁在潮湿空气中生锈主要是发生了电化学腐蚀
具有氧化性,其稀溶液可用于消毒
D . 钢铁在潮湿空气中生锈主要是发生了电化学腐蚀
有A、B、C、D四种金属,将A与B用导线连接起来,浸入电解质溶液中,B为正极, 将C、D分别投入等浓度盐酸中,C比D反应剧烈。将铜浸入B的盐溶液里,无明显变化。 如果把铜浸入C的盐溶液里,有金属C析出。据此判断它们的活动性由强到弱的顺序是 ( )
A . DCAB
B . DABC
C . DBAC
D . ABCD
下列有关铝及其化合物的性质说法正确的是( )
A . Al2O3熔点高,可用作耐高温材料
B . 用坩埚钳夹住一小块用砂纸仔细打磨过的铝箔在酒精灯上加热,发现熔化后的液态铝滴落下来,所以金属铝的熔点较低
C . 把用砂纸打磨过的铝条放入浓硝酸中,产生红棕色气体
D . 把氯化铝溶液滴入浓氢氧化钠溶液中,产生大量白色沉淀
下列操作或现象正确的是( )
| ① | ② | ③ | ④ |
| | | | |
| 对二次电池充电 | 验证Na2O2溶于水的热效应 | 中和热的测定 | 证明铁生锈时空气中O2参与反应 |
A . ②④
B . ①②③
C . ①②④
D . ①②③④
下列物质间的转化在给定条件下不能实现的是( )
A . NaHCO3(s)  Na2CO3(s)
Na2CO3(s)  NaOH(aq)
B . KClO3(s)
NaOH(aq)
B . KClO3(s)  Cl2
Cl2  Ca(ClO)2
C . Fe3O4(s)
Ca(ClO)2
C . Fe3O4(s)  Fe
Fe  FeCl2(s)
D . Na
FeCl2(s)
D . Na  Na2O2
Na2O2  NaCl(aq)
NaCl(aq)
 Na2CO3(s)
Na2CO3(s) 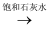 NaOH(aq)
B . KClO3(s)
NaOH(aq)
B . KClO3(s)  Cl2
Cl2  Ca(ClO)2
C . Fe3O4(s)
Ca(ClO)2
C . Fe3O4(s)  Fe
Fe 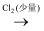 FeCl2(s)
D . Na
FeCl2(s)
D . Na  Na2O2
Na2O2  NaCl(aq)
NaCl(aq)
将a、b、c3种金属浸入稀盐酸中,用导线两两相连可以组成各种原电池。若a、b相连,b上有气泡逸出;a、c相连,c质量减少。则3种金属的活动性顺序由大到小排列为( )
A . a>b>c
B . c>a>b
C . a>c>b
D . b>a>c
最近更新