第一节 金属的化学性质 知识点题库
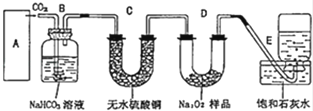
过氧化钠是一种淡黄色固体,在潜水艇中用作制氧剂,供人类呼吸之用.某学生为了验证这一实验,以足量的大理石、足量的盐酸和1.95g过氧化钠样品为原料,制取O2 , 设计出实验装置(如图):
(1)请写出过氧化钠与水反应的离子方 程式 ;
(2)A中为制取CO2的装置,写出有关反应的离子方程 ;
(3)B装置发生反应的化学方程式 ;
(4)若E中石灰水出现轻微白色浑浊,请说明原因: ;
(5)反应完毕时,若测得E中的集气瓶收集到的气体为250mL,又知氧气的密度为1.43g/L,当装置的气密性良好的情况下,实际收集到的氧气体积比理论计算值 (填大或小),相差约 mL(取整数值,所用数据均在标准状况下测定),这可能是由于 (写出一个原因即可).
①黄色溶液很快变成红褐色,过一会儿溶液中有红褐色沉淀生成.
②铝片表面立刻有少量黑色物质析出,黑色物质能被磁铁吸起.
③混合液温度升高甚至发烫,产生无色气泡,且产生气泡速率明显加快,铝片上下翻滚.
-
(1) 产生的红褐色沉淀是,无色气泡的成分是.
-
(2) 生成红褐色沉淀的原因是.
-
(3) 写出生成气泡速率明显加快的两个原因、.
金属钠(银白色)  变
变  变白色
变白色  表面潮湿
表面潮湿  形成白色晶体
形成白色晶体  形成白色粉末
形成白色粉末
请回答下列问题:
-
(1) 白色粉末的化学式是,过程②的化学方程式是.
-
(2) 下列说法正确的是 .A . 过程③为物理变化 B . 过程④是碳酸钠吸收空气中的CO2、水蒸气形成了碳酸氢钠 C . 过程⑤发生了分解反应 D . 整个变化过程中只有一个氧化还原反应.
 C . 铝的质量为
C . 铝的质量为 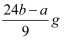 D . 与金属反应后剩余盐酸为(C1V1-2b)mol
D . 与金属反应后剩余盐酸为(C1V1-2b)mol
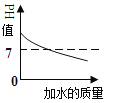 向pH=13的NaOH溶液中不断加水稀释
B .
向pH=13的NaOH溶液中不断加水稀释
B . 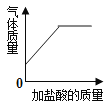 向碳酸氢钠溶液中逐滴加入稀盐酸至过量
C .
向碳酸氢钠溶液中逐滴加入稀盐酸至过量
C . 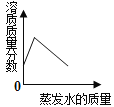 将60℃接近饱和的硝酸钾溶液恒温蒸发水分至有白色晶体析出
D .
将60℃接近饱和的硝酸钾溶液恒温蒸发水分至有白色晶体析出
D . 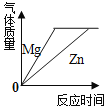 将足量的金属镁片和锌片分别和等质量、相同质量分数的稀硫酸混合
将足量的金属镁片和锌片分别和等质量、相同质量分数的稀硫酸混合
| 选项 | 实验操作 | 现象 | 结论 |
| A | 用洁净的铂丝蘸取待测液在酒精灯火焰上灼烧 | 火焰呈黄色 | 待测液中含Na+ , 不含K+ |
| B | 常温下,将铁片浸入足量浓硝酸 | 铁片不溶解 | 铁与浓硝酸不 反应 |
| C | 向某Na2SO3样品中加入足量Ba(NO3)2溶液,再加入足量稀盐酸 | 先产生白色沉淀,后沉淀不溶解 | Na2SO3已被氧化 |
| D | 将木炭与浓硫酸共热产生的气体依次通入过量的酸性高锰酸钾溶液和澄清石灰水中 | 高锰酸钾溶液紫色变浅,澄清石灰水变浑浊 | 反应产生SO2和CO2 |

①Al ②Al2O3 ③Al(OH)3 ④Na2CO3溶液 ⑤Ca(HCO3)2溶液 ⑥KHSO4溶液
| 选项 | X | Y |
| A | Al | NaOH溶液 |
| B | NO2 | H2O |
| C | Na2O2 | CO2 |
| D | Fe | H2O(g) |
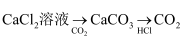 B .
B .  C .
C .  D .
D . 
编号 | 药品 | 保存方法 | 理由 |
A | 钠 | 保存在酒精中 | 防止钠与空气中的水、氧气等反应 |
B | 液溴 | 密封保存在细口瓶中,用水封和石蜡封 | 防止液溴挥发 |
C | 浓硝酸 | 密封保存在铁质容器中 | 避免见光分解 |
D | 烧碱 | 存放在带磨口玻璃塞的广口瓶中 | 防止与空气中的二氧化碳接触而变质 |



