第一节 元素周期表 知识点题库
完成金属锂的有关问题
(1)锂元素周期表中的位置 .
(2)金属锂是密度最小的金属.等质量的金属,锂能释放更多的电子,故常用来制造高能量电池.已知锂的金属性介于钠和镁之间,则下列能冶炼出金属锂的方法是 .
A.电解法 B.热还原法 C.热分解法 D.铝热法
(3)在元素周期表中位于对角线的元素性质有相似性,如锂和镁.下列关于金属锂的说法不正确的是 .
A.金属锂是最轻的金属 B.锂可以和冷水缓慢反应放出氢气
C.碳酸锂易溶于水 D.氢氧化钠碱性强于氢氧化锂
(4)下列有关碱金属的说法中,正确的是 .
A.金属锂应保存在煤油中
B.金属钾着火应用泡沫灭火剂更好
C.它们都能在空气里燃烧生成M2O(M表示碱金属)
D.碱金属单质随着核电荷数的递增与水反应的剧烈程度逐渐加剧直至燃烧爆炸.
(5)金属锂是一种重要的储氢材料,吸氢和放氢反应原理如下:
吸氢反应:2Li+H2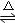 2LiH
2LiH
放氢反应:LiH+H2O═LiOH+H2↑
①放氢反应中的氧化剂是 .
②已知LiH为离子化合物,写出LiH的电子式 .
(6)锂电池是一代新型高能电池,它以质量轻、能量高而受到了普遍重视,目前已研制成功多种锂电池. 某种锂电池的总反应式是Li+MnO2═LiMnO2 . 下列说法正确的是 .
A.Li是负极,电极反应为Li﹣e﹣═Li+
B.Li是正极,电极反应为Li+e﹣═Li﹣
C.MnO2是负极,电极反应为MnO2+e﹣═MnO2﹣
D.锂电池是一种环保型电池.
 呼气法在医学上常用于门螺旋杆菌的诊断,下列关于
呼气法在医学上常用于门螺旋杆菌的诊断,下列关于  的说法中正确的是( )
的说法中正确的是( )
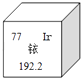
回答下列问题:
-
(1) 基态Se原子的价层电子排布式为。
-
(2) Cd的第一电离能大于同周期相邻元素,原因是。
-
(3) CdS、CdSe、CdTe均为重要的Ⅱ-Ⅵ族化合物半导体材料,熔点分别为1750℃、1350℃、1041℃,上述熔点呈规律性变化的原因是。
-
(4) 利用有机配体PH3、N(CH3)3等修饰(CdSe)2可改善其光致发光效率。其中PH3的空间构型是。N(CH3)3中参与形成配位键的孤电子对占据的轨道是。
-
(5) CdSe的一种晶体为闪锌矿型结构,晶胞结构如图所示。其中原子坐标参数A为(
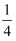 ,
, 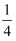 ,
, 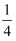 ),则B、C的原子坐标参数分别为。该晶胞中CdSe键的键长为。已知Cd和Se的原子半径分别为rCdnm和rSenm,则该晶胞中原子的体积占晶胞体积的百分率为。
),则B、C的原子坐标参数分别为。该晶胞中CdSe键的键长为。已知Cd和Se的原子半径分别为rCdnm和rSenm,则该晶胞中原子的体积占晶胞体积的百分率为。 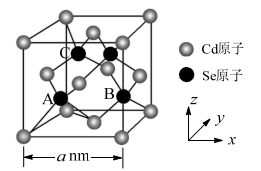

根据判断出的元素回答问题:
-
(1) f在元素周期表的位置是。
-
(2) 比较d、e常见离子的半径的小(用化学式表示,下同)>;比较g、h的最高价氧化物对应的水化物的酸性强弱是:>。
-
(3) 任选上述元素组成一种四原子共价化合物,写出其电子式。
-
(4) 已知1mole的单质在足量d2中燃烧,恢复至室温,放出255.5kJ热量,写出该反应的热化学方程式:。
-
(5) 上述元素可组成盐R:zx4f(gd4)2,向盛有10mL1mol·L-1R溶液的烧杯中滴加1mol·L-1NaOH溶液,沉淀物质的量随NaOH溶液体积变化示意图如下:
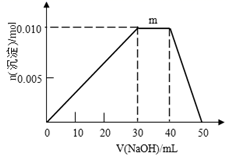
①R离子浓度由大到小的顺序是:。
②写出m点反应的离子方程式。
③若R溶液改加20mL1.2 mol·L-1Ba(OH)2溶液,充分反应后,溶液中产生沉淀的物质的量为mol。
-
(1) 碳酸锂制取锂的反应原理为:
①
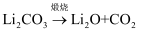 ;
;②
 。
。锂原子的电子排布式为;CO2的结构式为;反应②中物质涉及的化学键类型有。
-
(2) 碳原子核外电子有种不同能量的电子,其中有两个电子的能量最高且能量相等,这两个电子所处的轨道分别是。
-
(3) 氢化锂(LiH)是离子化合物,写出其阴离子的电子式,氢负离子(H-)与锂离子具有相同电子层结构,试比较两者微粒半径的大小,并用原子结构理论加以解释:。
-
(4) 用
 、氨水和液溴制备
、氨水和液溴制备  。除生成
。除生成  外,还产生了两种参与大气循环的气体,补全产物并配平该反应的化学方程式:
外,还产生了两种参与大气循环的气体,补全产物并配平该反应的化学方程式: 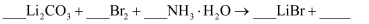 ,。
,。
-
(5) 磷酸亚铁锂电池总反应为:
 ,放电时,负极为(填写化学式)。若用该电池电解饱和食盐水(电解池电极均为惰性电极),当电解池两极共有
,放电时,负极为(填写化学式)。若用该电池电解饱和食盐水(电解池电极均为惰性电极),当电解池两极共有  气体(标准状况)产生时,该电池消耗锂的质量为。
气体(标准状况)产生时,该电池消耗锂的质量为。
|
X |
Y |
Z |
|
|
Q |
R |

-
(1) A是1~36号元素原子核外电子排布中未成对电子数最多的元素,A元素的名称是,在元素周期表中的位置是。
-
(2) B元素基态原子的轨道表示式是下图中的(填序号),另一轨道表示式不能作为基态原子的轨道表示式是因为它不符合(填序号)。
①

②

A.能量最低原则 B.泡利不相容原理 C.洪特规则
-
(3) 下图表示8种短周期元素的原子序数(图中原子序数是连续的)和元素常见单质沸点的关系。其中第一电离能和电负性最大的元素分别是、(填序号);C、D、F元素的简单离子的半径由大到小的顺序是(用离子符号表示)。

 , Ka=5.81×10-10 , 可判断H3WO3是一元弱酸
, Ka=5.81×10-10 , 可判断H3WO3是一元弱酸
 和
和 均具有漂白性,但漂白原理不同
均具有漂白性,但漂白原理不同



