第一节 开发利用金属矿物和海水资源 知识点题库
金属材料在日常生活以及生产中有着广泛的运用。下列关于金属的说法不正确的是( )
A . 合金的性质与其成分金属的性质不完全相同
B . 工业上金属Mg、Al都是用电解熔融的氯化物制得的
C . 金属冶炼的本质是金属阳离子得到电子变成金属原子
D . 越活泼的金属越难冶炼,冶炼方法与其活泼性有关
关于电解法精炼铜的下列说法正确的是( )
A . 电解结束后,在阳极底部会有阳极泥产生,主要成分是铁、金和银
B . 电解结束后,溶液中Cu2+浓度变大
C . 纯铜作阳极,粗铜作阴极,硫酸铜为电解质溶液
D . 粗铜作阳极,纯铜作阴极,硫酸铜为电解质溶液
以下物质的工业制备所用主要原料(括号内物质)不符合事实的是( )
A . 乙烯(乙醇)
B . 顺丁橡胶(石油裂解气)
C . 碘(海带)
D . 溴(海水晒盐后的余液)
综合利用海水可以制备食盐、纯碱、金属镁、溴等物质,其流程如图所示:

-
(1) 利用海水可制备Cl2 , 为便于储存,可将Cl2液化,应采取的措施之一是.
-
(2) 粗盐中含有硫酸钠、氯化镁、氯化钙等可溶性杂质,为除去这些杂质而得精盐,进行如下操作:①溶解 ②加过量的BaCl2溶液 ③加过量的NaOH溶液 ④加过量的Na2CO3溶液 ⑤(填操作名称,下同) ⑥加适量的盐酸 ⑦
-
(3) 气体X为.溶液b中发生反应的化学方程式是.
-
(4) 步骤I中已获得Br2 , 步骤Ⅱ中又将Br2还原为Br﹣ , 其目的为.步骤Ⅱ中通入空气吹出Br2 , 用SO2水溶液进行吸收,得到溶液c,反应的离子方程式为.在实验室中,从工业溴中提取溴单质的实验操作名称是.
-
(5) 工业上制取金属镁的化学方程式为.
碘是人体必须的元素之一,海洋植物如海带、海藻中含有丰富的、以碘离子形式存在的碘元素.在实验室中,从海藻里提取碘的流程如图1和实验装置如图2:

-
(1) 指出上述提取碘的过程中有关实验操作的名称:步骤③,步骤⑤.
-
(2) 写出步骤④对应反应的离子方程式:
-
(3) 提取碘的过程中,可供选择的有机试剂是 (填编号)A . 醋酸 B . 苯 C . 四氯化碳 D . 酒精
-
(4) 为了使海藻灰中的碘离子转化为碘的有机溶液,即完成步骤③至⑤,实验室里有烧杯、玻璃棒、集气瓶、酒精灯、导管、圆底烧瓶、石棉网、以及必要的夹持仪器和物品,尚缺少的玻璃仪器是.
-
(5) 从含碘的有机溶剂中提取碘和回收有机溶剂,还需要经过蒸馏.指出如图实验装置中存在的错误之处:.
海水中蕴藏着丰富的资源.海水综合利用的流程图如图.

-
(1) 粗盐中含Ca2+、Mg2+、Fe3+、SO42﹣及泥沙等杂质,需要提纯后才能综合利用.粗盐提纯的步骤有:①加入过量的Na2CO3溶液;②加入过量的BaCl2溶液;③加入过量的NaOH溶液;④调节溶液的pH等于7;⑤溶解;⑥过滤;⑦蒸发.正确的操作顺序是 (填写序号字母).A . ⑤①③②④⑥⑦ B . ⑤①②③⑥④⑦ C . ⑤③①②⑥④⑦ D . ⑤③②①⑥④⑦
-
(2) NaCl做原料可以得到多种产品.
①工业上由金属钠制备过氧化钠的方法是:将金属钠迅速升温至熔化,并控制温度在300﹣400℃,通入经处理过的空气可制得过氧化钠,处理空气的目的是.工业生产中因温度过低而得不到纯净的过氧化钠,你认为可能含有的杂质是(填化学式).
②实验室用惰性电极电解100mL0.1mol/LNaCl溶液,若阴阳两极均得到112mL气体(标准状况),则所得溶液的pH为(常温下)(忽略反应前后溶液的体积变化).
③电解氯化钠稀溶液可制备“84消毒液”,通电时氯气被溶液完全吸收,若所得消毒液仅含一种溶质,写出相应的化学方程式:.
-
(3) 分离出粗盐后的卤水中蕴含着丰富的镁资源,经转化后可获得MgCl2粗产品.
①粗产品的溶液中含有Na+、Fe2+、Fe3+和Mn2+ , 需将Fe2+、Fe3+、Mn2+转化为沉淀除去.因此先向溶液中加入一种上述(1)中得到的物质NaClO,然后控制溶液的pH为.
②由MgCl2•6H2O晶体制备无水MgCl2的方法是.
海洋中蕴藏着巨大的化学资源,下列有关海水综合利用的说法正确的是( )
A . 蒸发海水可以生产单质碘
B . 蒸馏海水可以得到淡水
C . 电解海水可以得到单质镁
D . 电解海水可以制得金属钠
和硅同一主族的锗也是重要的半导体材料,锗应用于航空航天测控、光纤通讯等领域。一种提纯二氧化锗粗品(主要含GeO2、As2O3)的工艺如下:
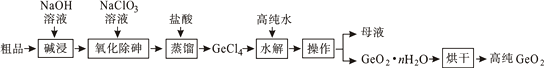
已知:①“碱浸”过程中的反应为:GeO2+2NaOH=Na2GeO3+H2O、As2O3+2NaOH=2NaAsO2+H2O
② GeCl4的熔点为-49.5℃,AsCl3与GeCl4的沸点分别为130.2℃、84℃。
-
(1) 砷的原子序数为33,砷在元素周期表中的位置为第周期第族。
-
(2) “氧化除砷”的过程是将NaAsO2氧化为Na3AsO4 , 其反应的离子方程式为: 。
-
(3) 传统的提纯方法是将粗品直接加入盐酸中蒸馏,其缺点是。
-
(4) “蒸馏”过程中的反应的化学方程式为:。
-
(5) “水解”操作时保持较低温度有利于提高产率,其最可能的原因是(答一条即可)。
-
(6) 若1吨二氧化锗粗品(含杂质30%)经提纯得0.745吨的较纯二氧化锗产品,则杂质脱除率为。
-
(7) 和砷同一主族的锑也可以用于半导体中。一种突破传统电池设计理念的镁—锑液态金属二次电池工作原理如图所示:

该电池由于密度的不同,在重力作用下分为三层,工作时中间层熔融盐的组成不变。充电时,Cl-向(填“上”或“下”)移动;放电时,正极的电极反应式为。
以CuSO4溶液为电解质溶液进行粗铜(合Zn、Ag、Pt、Au等杂质)的电解精炼,下列说法正确的是( )
A . 电能全部转化为化学能
B . 反应溶液中Cu2+向阳极移动
C . 粗铜接电源正极,发生氧化反应
D . 利用阳极泥可回收Zn、Ag、Pt、Au等金属
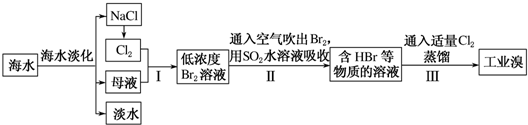
海水是巨大的资源宝库,从海水中提取食盐和溴的过程如下:
-
(1) 步骤Ⅰ中已获得Br2 , 步骤Ⅱ中又将Br2还原为Br- , 其目的为 .
-
(2) 步骤Ⅱ用SO2水溶液吸收Br2 , 吸收率可达
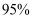 ,有关反应的离子方程式为;
,有关反应的离子方程式为;
-
(3) 从理论上考虑,下列物质也能吸收Br2的是____________.A . H2O B . Na2CO3 C . Na2SO3 D . FeCl3
-
(4) 某化学研究性学习小组为了解从工业溴中提纯溴的方法,查阅了有关资料,
 的沸点为
的沸点为 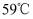 ,微溶于水,有毒性和强腐蚀性。步骤Ⅲ的操作中对盛有工业溴的蒸馏烧瓶采取的加热方式是 ,溴蒸汽冷凝后得到液溴和溴水的混合物,可利用它们的相对密度相差较大的特点进行分离,所用的分离仪器名称是 .
,微溶于水,有毒性和强腐蚀性。步骤Ⅲ的操作中对盛有工业溴的蒸馏烧瓶采取的加热方式是 ,溴蒸汽冷凝后得到液溴和溴水的混合物,可利用它们的相对密度相差较大的特点进行分离,所用的分离仪器名称是 .
下列金属用途和有关性质的对应关系错误的是( )
| 金属用途 | 金属的有关性质 | |
| A | 金可以制成比纸还薄的金箔 | 延展性 |
| B | 生活用铁锅 | 导热性 |
| C | 用铁回收照相定影废液中的银 | 氧化性 |
| D | 用铜制作印刷电路 | 导电性 |
A . A
B . B
C . C
D . D
化学与社会生活密切相关,下列说法正确的是( )
A . 军舰船底镶嵌锌块作正极,以防船体被腐蚀
B . 汽车尾气中NO和CO可以缓慢反应生成N2和CO2 , 减小压强,反应速率减慢
C . 金属冶炼过程是金属离子得电子变成金属单质的氧化过程
D . PM2.5颗粒  微粒直径约为2.5×10-6m)分散在空气中形成气溶胶
微粒直径约为2.5×10-6m)分散在空气中形成气溶胶
 微粒直径约为2.5×10-6m)分散在空气中形成气溶胶
微粒直径约为2.5×10-6m)分散在空气中形成气溶胶
下列说法错误的是( )
A . 镁的氧化物熔点很高,是优质的耐高温材料
B . 工业上采用热还原法来冶炼金属铁
C . 二氧化硫因具有还原性,可以用来漂白纸浆
D . 晶体硅是一种重要的半导体材料,是手机芯片中的主要成分
化学与生活、生产密切相关。下列叙述错误的是( )
A . 高纯硅可用于制作光导纤维
B . 碳酸钠热溶液呈碱性,可用于除去餐具上的油污
C . 利用太阳能蒸发海水的过程属于物理变化
D . 淀粉和纤维素水解的最终产物均为葡萄糖
下列金属用途与性质不相对应的是( )
A . 用铜做电线是由于其导电性良好
B . 用钨做灯丝是因为其熔点高
C . 铁制品表面镀铬是由于铬硬且不易被氧化
D . 性质活泼的金属铝成为应用广泛的金属材料主要是由于铝的延展性好
下列金属,在工业上常用电解法冶炼的是( )
A . 铜
B . 铝
C . 铁
D . 银
工业上常用电解法冶炼的金属是( )
A . Mg
B . Fe
C . Cu
D . Ag
2020 年 12 月 17 日嫦娥五号返回器携带月球样品成功返回地面。下列所涉及的材料属于金属材料的是( )

A . 超声电机的心脏——压电陶瓷
B . 主体框架——钛合金、铝合金
C . 国旗旗面——芳纶纤维
D . 发动机包裹材料——碳纤维
21世纪以来,国与国之间因对海洋权益的争夺引起的摩擦不断,在捍卫主权的同时,人们看重的是海洋这个巨大的资源宝藏。下列对于海水利用的认识错误的是( )
A . 海水中蕴藏着丰富的铁、锰、钴等金属元素,这些物质可以大量开发,以弥补资源的短缺
B . 淡化海水的方法主要有蒸馏法、电渗析法、离子交换法
C . 晒盐浓缩后得到的苦卤中含有浓度较高的溴离子,向苦卤中通入氯气,可以得到溴单质
D . 从海水中可以提取食盐、溴、钾盐、镁及其化合物、铀、重水、卤水等
利用下列装置及药品能达到实验目的的是( )
| A | B | C | D |
| 量取9.5mL液体 | 制备并收集NH3 | 完成铝热反应 | 制备并收集NO2 |
| | | | |
A . A
B . B
C . C
D . D
最近更新







