第一节 开发利用金属矿物和海水资源 知识点题库
化学与科学、技术、社会、环境密切相关,下列有关说法正确的是( )
A . 锅炉水垢中的硫酸钙可用碳酸钠溶液处理,使之转化为碳酸钙,再用酸除去
B . 日本福岛核电站爆炸时释放的两种放射性核素131I与137Cs的中子数相等
C . 铝合金的大量使用归功于人们能使用焦炭等还原剂从氧化铝中获得铝
D . 海水淡化可以解决淡水供应危机,向海水中加入明矾可以使海水淡化
下列有关工业生产的叙述正确的是( )
A . 合成氨生产过程中将NH3液化分离,可加快正反应速率,提高N2、H2的转化率
B . 硫酸工业中,为了提高SO2的转化率,用五氧化二钒作催化剂
C . 电解饱和食盐水制烧碱采用离子交换膜法,可防止阴极室产生的Cl2进入阳极室
D . 电解精炼铜时,同一时间内阳极溶解铜的质量比阴极析出铜的质量小
我国有广阔的海岸线,海水综合利用大有可为.海水中Br﹣含量为65mg•L﹣1 , 从海水中提取溴的工业流程如下:

-
(1) 以上步骤Ⅰ中已获得游离态的溴,步骤Ⅱ又将之转变成化合态的溴,其目的是:.
-
(2) 步骤Ⅱ通入热空气或水蒸气吹出Br2 , 利用了溴的 (填序号).A . 氧化性 B . 还原性 C . 挥发性 D . 腐蚀性
-
(3) 以上流程Ⅱ中涉及的离子反应如下,请在下面方框内填入适当的化学计量数:
Br2+CO32﹣═ BrO3﹣+Br﹣+CO2↑
-
(4) 上述流程中吹出的溴蒸气,也可先用二氧化硫水溶液吸收,再用氯气氧化后蒸馏.写出溴蒸气与二氧化硫水溶液反应的离子方程式:.
-
(5) 实验室从溴水中分离出溴还可以用溶剂萃取法,下列可以用作溴的萃取剂的是 (填序号).A . 乙醇 B . 四氯化碳 C . 裂化汽油 D . 苯
-
(6) 用上述流程制得含Br265%的工业溴1t,至少需要海水 m3 .
-
(7) 上述流程中吹出的溴蒸气,也可先用二氧化硫水溶液吸收,再用氯气氧化后蒸馏.写出溴与二氧化硫水溶液反应的离子方程式:.
电化学是研究化学能与电能相互转化的装置,过程和效率的科学.下列说法不正确的是( )
A . 铅蓄电池放电时,正极的质量会变小
B . 对于某耗氧燃料电池.无论负极通入何种燃料,若转移电子总数相等,则正极消耗等质量的氧气
C . 可以通过适当的电解装置实现反应2Ag+2H+=2Ag++H2↑
D . 电解精炼铜,阳极为粗铜,电镀铜,阳极为纯铜
把a、b、c、d四块金属片浸泡在稀硫酸中,用导线两两相连可以组成各种原电池.若a、b相连时,a为负极;c、d相连时,d上有气泡逸出;a、c相连时,a极减轻;b、d相连时,b为正极.则这四种金属活泼性顺序由强到弱的顺序为( )
A . a>b>c>d
B . a>c>b>d
C . a>c>d>b
D . b>d>a>c
下列反应原理中,不符合工业冶炼金属实际情况的是( )
A . 2Ag2O  4Ag+O2↑
B . 2Al2O3(熔融)
4Ag+O2↑
B . 2Al2O3(熔融)  4Al+3O2↑
C . 2MgO
4Al+3O2↑
C . 2MgO  2Mg+O2↑
D . 4CO+Fe3O4
2Mg+O2↑
D . 4CO+Fe3O4  3Fe+4CO2
3Fe+4CO2
 4Ag+O2↑
B . 2Al2O3(熔融)
4Ag+O2↑
B . 2Al2O3(熔融)  4Al+3O2↑
C . 2MgO
4Al+3O2↑
C . 2MgO  2Mg+O2↑
D . 4CO+Fe3O4
2Mg+O2↑
D . 4CO+Fe3O4  3Fe+4CO2
3Fe+4CO2
化学与社会、生产、生活紧切相关.下列说法正确的是( )
A . 石英只能用于生产光导纤维
B . 从海水中提取物质都必须通过化学反应才能实现
C . 为了增加食物的营养成分,可以大量使用食品添加剂
D . “地沟油”禁止食用,但可以用来制肥皂
下列化学方程式正确的是( )
A . Cu+2HCl═CuCl2+H2↑
B . Al2O3+3H2O═2Al(OH)3
C . Mg(OH)2 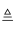 MgO+H2O
D . Ba(OH)2+SO2═BaSO4↓+H2O
MgO+H2O
D . Ba(OH)2+SO2═BaSO4↓+H2O
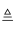 MgO+H2O
D . Ba(OH)2+SO2═BaSO4↓+H2O
MgO+H2O
D . Ba(OH)2+SO2═BaSO4↓+H2O
根据下列反应事实写出相应的化学方程式。
-
(1) 双氧水在二氧化锰的催化作用下生成水和氧气:。
-
(2) 在尘埃的作用下,二氧化硫和氧气反应生成三氧化硫(SO3):。
-
(3) Cu和AgNO3溶液反应,生成Cu(NO3)2溶液和Ag:。
-
(4) 少量CuSO4溶液滴入NaOH稀溶液中生成Cu(OH)2沉淀和Na2SO4溶液:。
-
(5) 一氧化碳和四氧化三铁(Fe3O4)在高温下反应,生成铁和二氧化碳:。
海洋约占地球表面积的71%,对其开发利用的部分流程如图所示。下列说法错误的( )
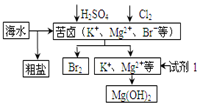
①试剂1可以选用NaOH溶液;
②从苦卤中提取Br2的反应的离子方程式为:2Br-+Cl2=Br2+2Cl-
③工业上,电解熔融MgO冶炼金属镁可减小能耗;
④制铝:工业上电解熔融氯化铝来制备铝;
⑤制钠:电解饱和NaCl溶液;
⑥炼铁:CO在高温下还原铁矿石中的铁
A . ①②④⑥
B . ②③④⑥
C . ①③④⑥
D . ①③④⑤
“空气吹出法”海水提溴的工艺流程如图:

下列说法正确的是( )
A . 从吹出塔进入吸收塔的物质只有Br2
B . 从吸收塔流出的溶液主要含HBr和H2SO4
C . 两次通入水蒸气的作用都是参加反应
D . 第一次通入Cl2的目的是氧化Br- , 第二次通Cl2的目的是氧化SO2
工业上常用热还原法冶炼的金属是( )
A . Na
B . Fe
C . Al
D . Ag
地球上的金属矿物资源是有限的,应合理开发利用。
-
(1) 金属冶炼的实质是金属离子被(填“氧化”或“还原”)生成金属单质。
-
(2) 铜在自然界存在于多种矿石中,如:
矿石名称
黄铜矿
辉铜矿
孔雀石
主要成分
CuFeS2
Cu2S
Cu2(OH)2 CO3
请回答下列问题:
① 上表所列铜化合物中,推断铜的质量百分含量最高的是。
② CuFeS2其中 Cu 为+1 价、Fe 为+3 价,高温焙烧时发生的反应是CuFeS2 + O2
 SO2 +FeS +Cu,焙烧过程中被还原的元素有。
SO2 +FeS +Cu,焙烧过程中被还原的元素有。③ 工业上以黄铜矿为原料,采用火法熔炼工艺生产铜,火法炼铜的反应为:Cu2S+O2
 2Cu+SO2 , 该反应中氧化剂是。
2Cu+SO2 , 该反应中氧化剂是。④ Cu2(OH)2 CO3 与稀硫酸反应的离子方程式为。
下列说法正确的是( )
A . 工业采用氢气与氯气混合点燃,加水稀释的方法制备盐酸
B . 工业上制备硝酸时,常将通过吸收塔的尾气重新转移至热交换器中,以便于尾气进行后期的循环利用
C . 工业上常采用电解饱和食盐水的方法制备钠单质
D . 工业上常将氯气通入海水的母液中,再进行结晶、过滤从而获得溴单质
一种以铝矿(主要成分为 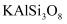 、
、  和
和  等)为原料生产金属铝的工艺流程如下:
等)为原料生产金属铝的工艺流程如下:
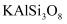 、
、  和
和  等)为原料生产金属铝的工艺流程如下:
等)为原料生产金属铝的工艺流程如下: 
已知几种氯化物在常压时的熔、沸点:
| 物质 | SiCl4 | AlCl3 | NaCl | KCl | CaCl2 |
| 沸点/℃ | 58 | 180 | 1465 | — | 1935 |
| 熔点/℃ | -69 | — | 801 | 771 | 775 |
回答下列问题:
-
(1) CaAl2Si2O8用氧化物形式可表示为.
-
(2) “流化”阶段温度保持在900℃以上,使铝土矿中物质全部转化为氯化物。
①“流化过程中NaAlSi3O8发生的化学反应方程式为.
②Ⅱ级冷凝的温度不能高于℃
-
(3) “操作Ⅱ”的名称是,“操作Ⅲ”的名称是。
-
(4) 副产物A为;
-
(5) 尾气含有剧毒的COCl2 , 它能被强碱溶液能吸收,其反应的离子方程式为。
下列关于金属及其化合物的说法正确的是( )
A . 已知CCl4不可燃且不与Na反应,故少量的Na可保存在CCl4液体中
B . 向紫色石蕊试液中加入较多Na2O2粉末,溶液变为蓝色并有气泡产生
C . 还原铁粉与水蒸气在高温下反应生成有磁性的氧化亚铁
D . 胃酸过多的病人,可以服用适量含有氢氧化铝的胃药
下列有关金属的工业制法中错误的是( )
A . 制镁:用铝与氧化镁的混合物作铝热剂冶炼镁
B . 制铝:以铝土矿为原料获得氧化铝固体,电解熔融的氧化铝得到铝
C . 制汞:用加热氧化汞的方法冶炼汞
D . 制铁:利用焦炭与氧气反应生成的CO在高温下还原铁矿石得到铁
已知海水提取镁的主要步骤如下:

-
(1) 关于加入试剂①作沉淀剂,有以下方法,请完成下列问题。
方法
是否合理
简述理由
方法:高温加热蒸发海水后,再加入沉淀剂
a
b
你认为合理的其他方法是c
a. ;
b.;
c.。
-
(2) 框图中加入的试剂①应该是(填物质名称),加入试剂②的溶质是(填化学式)。工业上由无水
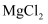 制取镁的化学方程式为。
制取镁的化学方程式为。
海水中溴元素以Br形式存在,工业上用空气吹出法从海水中提取溴的工艺流程如图所示:

下列说法错误的是( )
A . 浓缩海水采用的方法是蒸发
B . 从混合物Ⅰ到混合物Ⅱ,实现了溴的富集
C . 步骤②通入热空气吹出 , 利用了
, 利用了 的挥发性
D . 实验室中可用过滤的方法从混合物Ⅱ中分离出
的挥发性
D . 实验室中可用过滤的方法从混合物Ⅱ中分离出
 , 利用了
, 利用了 的挥发性
D . 实验室中可用过滤的方法从混合物Ⅱ中分离出
的挥发性
D . 实验室中可用过滤的方法从混合物Ⅱ中分离出
下列说法正确的是( )
A . 工业上通过电解六水合氯化镁制取金属镁
B . 接触法制硫酸时,煅烧黄铁矿以得到三氧化硫
C . 浓硝酸与铁在常温下不反应,所以可用铁质容器贮运浓硝酸
D . “洁厕灵”(主要成分为盐酸)和“84消毒液”(主要成分为次氯酸钠)不能混用
最近更新



