第一节 开发利用金属矿物和海水资源 知识点题库
下列说法正确的是
A . 通常用石油的年产量来衡量一个国家的石油化学工业发展水平
B . 酸雨的形成主要是汽车排出大量尾气
C . 可用焦炭或一氧化碳还原氧化铝的方法来冶炼铝
D . 二氧化碳在我国重点城市近年来已发布的“空气质量日报”中不列入首要污染物
海洋约占地球表面积的71%,对其进行开发利用的部分流程如图所示.下列说法错误的是( )

A . 试剂1可以选用石灰乳
B . 从苦卤中提取Br2的反应的离子方程式为:2Br﹣+Cl2═2Cl﹣+Br2
C . 工业上,电解熔融MgO冶炼金属镁可减小能耗
D . 可用BaCl2溶液除去粗盐中的SO42﹣
下列工业制备的反应原理选择不恰当的是( )
A . 制乙醇:CH3CHO+H2 CH3CH2OH
B . 制盐酸:H2+Cl2
CH3CH2OH
B . 制盐酸:H2+Cl2 2 HCl
C . 制烧碱:2NaCl+2H2O
2 HCl
C . 制烧碱:2NaCl+2H2O  2 NaOH+H2↑+Cl2↑
D . 湿法冶炼铜:Fe+CuSO4=Cu+FeSO4
2 NaOH+H2↑+Cl2↑
D . 湿法冶炼铜:Fe+CuSO4=Cu+FeSO4
 CH3CH2OH
B . 制盐酸:H2+Cl2
CH3CH2OH
B . 制盐酸:H2+Cl2 2 HCl
C . 制烧碱:2NaCl+2H2O
2 HCl
C . 制烧碱:2NaCl+2H2O  2 NaOH+H2↑+Cl2↑
D . 湿法冶炼铜:Fe+CuSO4=Cu+FeSO4
2 NaOH+H2↑+Cl2↑
D . 湿法冶炼铜:Fe+CuSO4=Cu+FeSO4
化学与生活密切相关,下列叙述正确的是( )
A . 光纤通信使用的光缆主要成分是Si,太阳能电池使用的材料主要是SiO2
B . 点燃爆竹后,硫燃烧生产SO3
C . 海水中含有溴元素,只进行物理变化就可以得到溴单质
D . “地沟油”禁止使用,但可以用来制取肥皂
海水是十分重要的资源.不需要化学方法就能从海水中获得的物质有( )
A . 氯、溴、碘
B . 食盐、淡水
C . 烧碱、氢气
D . 钠、镁、铝
冶炼金属一般有下列四种方法:①焦炭法;②水煤气(H2或CO)法;③活泼金属置换法;④电解法.四种方法各有优缺点,在工业上均有应用.
-
(1) 一种无色气体A与红热的炭反应,得到另一种无色气体B,B与灼热的氧化铜反应,又得到A,则A、B分别为 (填序号).A . O2、CO2 B . O2、CO C . CO2、CO D . CO、CO2
-
(2) 下列说法错误的是 (填序号).A . 对废旧金属最好的处理方法是回收、再利用 B . 提炼金属要经过矿石的富集、冶炼、精炼三步 C . 活泼金属的冶炼都是通过电解其盐溶液制得 D . 热还原法中还原剂有焦炭、一氧化碳、氢气或活泼金属等
-
(3) 钛(Ti)有“未来钢铁”之称,工业上常以TiCl4+2Mg
 Ti+2MgCl2获得海绵状钛,该反应在下列哪种环境中进行 (填序号).
A . 稀有气体中 B . 空气中 C . 氮气中 D . CO2气体中.
Ti+2MgCl2获得海绵状钛,该反应在下列哪种环境中进行 (填序号).
A . 稀有气体中 B . 空气中 C . 氮气中 D . CO2气体中.
粗铜的电解精炼如图所示.在粗铜的电解过程中,粗铜板应是图中电极(填图中的字母);在电极d上发生的电极反应式为.

对于金属,下列叙述正确的是( )
A . 点燃镁、铝前应用砂纸打磨,除去表面的氧化膜
B . 用砂纸打磨的铝条,放在酒精灯上加热至熔化,铝会滴落下来
C . 铁在氧气中燃烧的产物主要成分是Fe2O3
D . 金属单质在自然界中都以化合物存在,因为它们都有较强的还原性
下列有关金属元素特征的叙述正确的是( )
A . 金属元素的原子只有还原性,其阳离子只有氧化性
B . 在化学反应中,由于铝原子能失去三个电子,而钠原子只能失去一个电子,所以铝的还原性比钠强
C . 钠元素在自然界中以化合态存在
D . 金属元素的单质在常温下都为固体
从海水中可提取多种化工原料,下面是工业上对海水的几项综合利用的示意图.

-
(1) .海水所得粗盐中含Ca2+、Mg2+、SO42﹣等杂质,为了有效除去Ca2+、Mg2+、SO42﹣ , 加入试剂的合理顺序为.
A.先加NaOH,后加Na2CO3 , 再加Ba2+试剂
B.先加NaOH,后加Ba2+试剂,再加Na2CO3
C.先加Ba2+试剂,后加NaOH,再加Na2CO3
要除去SO42﹣ , 必须添加钡试剂,该钡试剂可以是.
A.Ba(OH)2 B. Ba(NO3)2 C.BaCl2
-
(2) .写出用Ca(OH)2制取氢氧化镁的化学方程式:.
从经济效益角度看,该化工厂的厂址应选择在.
为探索工业含铝、铁、铜合金废料的再利用,甲同学设计的实验方案如下:

请回答:
-
(1) 绿矾的化学式为.
-
(2) 写出反应①的化学方程式,反应②生成沉淀的离子反应方程式.
-
(3) 为了检测滤液D中含有的金属离子,可设计实验方案为(试剂自选):.
-
(4) 在滤渣B中滴加稀硫酸时,发现反应速率比一般的铁粉反应要快,其原因是.
-
(5) 若考虑绿色化学工艺,在滤渣E中加入稀硫酸和试剂Y制胆矾晶体,试剂Y为无色液体,则反应④的总化学方程式为;若不考虑绿色化学工艺,所选试剂Y为1mol/L的硝酸,欲使3molCu全部溶解且溶液中含铜元素的溶质仅为CuSO4 , 则需该硝酸的体积L.
从海水中提取镁,可按如下步骤进行:
①把贝壳制成石灰乳
②在引入的海水中加入石灰乳,沉降、过滤,洗涤沉淀物
③将沉淀物与盐酸反应,结晶过滤,干燥产物
④冶炼③的产物得到金属Mg
关于提取镁,下列说法错误的是( )
A . 此法的优点之一是原料来源丰富
B . 进行①②③步骤的目的是从海水中提取MgCl2
C . 用③的产物冶炼金属Mg,可以用热还原法(还原剂C、CO、H2)
D . 以上提取镁的过程中涉及的反应有分解反应、化合反应和复分解反应
下列叙述正确的是()
A . 浓硫酸具有强腐蚀性,可用浓硫酸刻蚀石英制艺术品
B . 我国预计2020年发射首颗火星探测器,其太阳能电池帆板的材料是晶体硅
C . “海水淡化”可以解决淡水供应危机,向海水中加入明矾可以使海水淡化
D . “一带一路”是现代“丝绸之路”,丝绸的主要成分是纤维素
下列说法不正确的是( )
A . 门捷列夫根据元素的性质随着相对原子质量递增呈现周期性变化规律,制出了第一张元素周期律
B . 侯氏制碱法的原理是将CO2通入氨的NaCl饱和溶液中,使NaHCO3析出,NaHCO3受热分解生成Na2CO3 , NaHCO3和Na2CO3在食品工业上都有着广泛的应用
C . 石灰乳与海水混合,过滤得Mg(OH)2 , 将其溶于盐酸,再蒸发结晶得到MgCl2 , 电解熔融MgCl2可得到金属镁
D . 工业炼铁、从海水中提取镁、制玻璃、水泥过程中都需要用到石灰石
海水提溴时常用热空气或水热气将溴吹出制成粗溴,是因为单质溴( )
A . 性质稳定
B . 沸点低
C . 不溶于水
D . 易升华
信息时代产生的大量电子垃圾对环境构成了极大的威胁。某“变废为宝”学生探究小组将一批废弃的线路板简单处理后,得到含 70%Cu、25%Al、4%Fe 及少量
Au、Pt 的合金,并设计出由合金制备硫酸铜和硫酸铝晶体的路线:
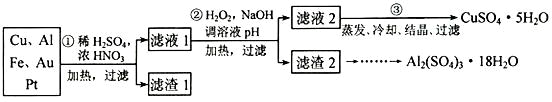
请回答下列问题:
-
(1) 第①步 Cu与酸反应的离子方程式为,得到滤渣 1的主要成分为。
-
(2) 第②步加 H2O2的作用是做氧化剂,将溶液中的 Fe2+氧化为 Fe3+ , 用 H2O2做氧化剂的优点是。
-
(3) 滤渣 2的主要成分是 Al(OH)3和 Fe(OH)3 , 在生产中如何分离两种沉淀,写出反应的离子方程式。
-
(4) 第③步蒸发所需玻璃仪器为。
X、Y、Z、M、N 代表五种金属,有以下反应:①Y 与 M 用导线连接放入稀硫酸中, M 上冒气泡; ②M、N 为电极,与 N 的盐溶液组成原电池,电子从 M 极流出,经过外电路,流入 N 极;③Z+2H2O(冷水)=Z(OH)2+H2↑;④水溶液中,X+Y2+=X2++Y;则这五种金属的活动性由强到弱的顺序为( )
A . Z>X>Y>M>N
B . Z>Y>X>M>N
C . Z>X>Y>N>M
D . X>Y>M>N>Z
有A、B、C、D四种金属,将A与B用导线连接起来,浸入电解质溶液中,B为正极, 将C、D分别投入等浓度盐酸中,C比D反应剧烈。将铜浸入B的盐溶液里,无明显变化。 如果把铜浸入C的盐溶液里,有金属C析出。据此判断它们的活动性由强到弱的顺序是 ( )
A . DCAB
B . DABC
C . DBAC
D . ABCD
浩瀚的海洋是一个巨大的物质宝库,工业上常用浓缩海水提取溴.
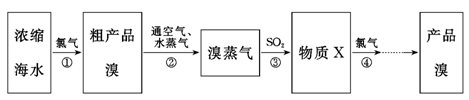
下列说法错误的是( )
A . 海水的淡化方法主要有蒸馏法、电渗析法、离子交换法等
B . 步骤②中体现了溴易挥发的性质
C . 步骤③反应的离子方程式为Br2+SO2+2H2O═2HBr+2H++SO42﹣
D . ①﹣④目的是为了富集溴元素
海洋中有丰富的食品、矿产、能源、药物和水产资源,下图为海水利用的部分过程。下列有关说法错误的是( )
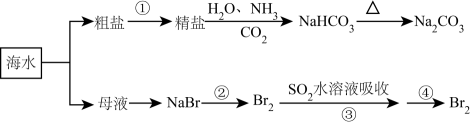
A . 在第②③④步骤中,溴元素均被氧化
B . 侯氏制碱过程中应先通 再通
再通 C . 制取
C . 制取 的反应是利用其溶解度小于NaCl
D . ③④的目的是进行溴的富集
的反应是利用其溶解度小于NaCl
D . ③④的目的是进行溴的富集
 再通
再通 C . 制取
C . 制取 的反应是利用其溶解度小于NaCl
D . ③④的目的是进行溴的富集
的反应是利用其溶解度小于NaCl
D . ③④的目的是进行溴的富集
最近更新



