第一节 开发利用金属矿物和海水资源 知识点题库
金属材料在日常生活、生产中有着广泛的运用,下列关于金属的说法不正确的是( )
A . 越活泼的金属越难冶炼
B . 合金的性质与其成分金属的性质不完全相同
C . 金属冶炼的本质是金属阳离子得到电子变成金属原子
D . 工业上金属Mg、Al都是用电解熔融的氯化物制得的
我国高炉生产各方面取得了显著进步,但在资源和能源利用率、高炉大型化、提高产业集中度以及环保等方面还跟国际存在很大差距,有待进一步提高,努力向钢铁强国迈进.请回答下列问题:
-
(1) 高炉炼铁的原料有铁矿、焦炭和石灰石,其中起熔剂作用的是,目的是除去铁矿石中的脉石,在铁水的上部形成炉渣而与铁水分离.
-
(2) 焦炭在高炉炼铁中起着举足轻重的作用,下列不属于焦炭作用的是________.A . 作为燃料,为炼铁中的化学反应提供能量 B . 作为还原剂与二氧化碳反应产生还原氧化铁的一氧化碳 C . 对高炉中的物料起到支撑和疏散的作用 D . 作为溶剂,除去铁矿石中的杂质
-
(3) 高炉炼铁的污染非常严重,目前我国部分大城市中的钢铁厂借着搬迁的机会也在进行着工艺改进.高炉炼铁导致的环境污染有________.A . 臭氧空洞 B . 酸雨 C . 一氧化碳毒害 D . 沙尘暴
-
(4) 写出高炉炼铁中与碳元素有关的氧化还原反应化学方程式:.
我国高炉生产各方面取得了显著进步,但在资源和能源利用率、高炉大型化、提高产业集中度以及环保等方面还跟国际存在很大差距,有待进一步提高,努力向钢铁强国迈进.请回答下列问题:
(1)高炉炼铁的原料有铁矿、焦炭和石灰石,其中起熔剂作用的是 ,目的是除去铁矿石中的脉石,在铁水的上部形成炉渣而与铁水分离。
(2)焦炭在高炉炼铁中起着举足轻重的作用,下列不属于焦炭作用的是 。
A.作为燃料,为炼铁中的化学反应提供能量
B.作为还原剂与二氧化碳反应产生还原氧化铁的一氧化碳
C.对高炉中的物料起到支撑和疏散的作用
D.作为溶剂,除去铁矿石中的杂质
(3)高炉炼铁的污染非常严重,目前我国部分大城市中的钢铁厂借着搬迁的机会也在进行着工艺改进。高炉炼铁导致的环境污染有 。
A.臭氧空洞 B.酸雨 C.一氧化碳毒害 D.沙尘暴
(4)写出高炉炼铁中与碳元素有关的氧化还原反应化学方程式: 。
下列生产、生活中的事实不能用金属活动性顺序表解释的是( )
A . 铝制器皿不宜盛放酸性食物
B . 电解饱和食盐水阴极产生氢气得不到钠
C . 铁制容器盛放和运输浓硫酸
D . 镀锌铁桶镀层破损后铁仍不易被腐蚀
物质的性质决定了物质的用途,下面列出了金属的几种性质:①导热性、②导电性、③还原性、④延展性、⑤具有金属光泽.请在下面金属用途后的横线上填上金属性质对应的序号.
(1)用铝定制成包装用的铝箔 ;(2)电信业中大量使用的铜丝、金属电缆 ;
(3)用铁粉回收照相业废液中的银 ;(4)用铝制成的高压铝锅 .
下列有关海水综合利用的说法正确的是( )
A . 电解饱和食盐水可制得金属钠
B . 海水提溴涉及到氧化还原反应
C . 海带提碘只涉及物理变化
D . 海水提镁不涉及复分解反应
下列关于铜电极的叙述中正确的是( )
A . 铜锌原电池中铜是负极
B . 用电解法精炼粗铜时粗铜作阳极
C . 在铁上电镀铜时用铜作阴极
D . 电解稀硫酸时用铜作阳极,阳极产生氧气
高纯度氧化铝有广泛的用途,某研究小组研究用以下流程制取高纯度氧化铝:
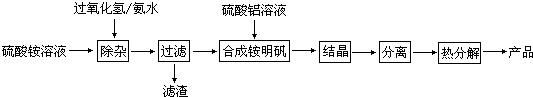
根据上述流程图填空:
-
(1) “除杂”操作是加入过氧化氢后,用氨水调节溶液的pH约为8.0,以除去硫酸铵溶液中的少量Fe2+ . 请写出在除去Fe2+离子的过程中,发生的主要反应的离子方程式.
-
(2) 通常条件下Ksp〔Fe(OH)3〕=4.0×10﹣38 , 除杂后溶液中c(Fe3+)约为.
-
(3) 配制硫酸铝溶液时,需用硫酸酸化,酸化的目的是.
-
(4) “结晶”这步操作中,母液经蒸发浓缩至溶液表面刚出现薄层晶体即停止加热,然后冷却结晶,得到铵明矾晶体(含结晶水).母液不能蒸干的原因是.
-
(5) “分离”操作的名称是 (填字母代号).A . 蒸馏 B . 分液 C . 过滤
-
(6) 铵明矾晶体的化学式为NH4Al(SO4)2•12H2O,在0.1mol/L铵明矾的水溶液中,离子浓度最大的离子是,离子浓度最小的离子是.
已知镍的金属活动性介于铁和锡之间.工业上以氧化镍矿为原料制得高纯度的金属镍,最适宜的方法为( )
A . 氧化镍高温分解
B . 电解熔融的氧化镍
C . 高温下用氢气还原氧化镍
D . 高温下用焦炭还原氧化镍
21世纪是海洋世纪,海洋经济专属区的开发受到广泛重视,下列有关说法正确的是( )
A . 海水含镁,将金属钠放入海水中可以制取金属镁
B . 从海水中提取溴的过程涉及氧化还原反应
C . 利用潮汐能发电是将化学能转化为电能
D . 海底多金属结核矿含有Fe、Mn、Co、B等金属
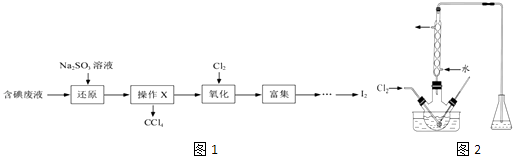
实验室从含碘废液(除H2O 外,含有CCl4、I2、I﹣等)中回收碘,其实验过程如图1
-
(1) 向含碘废液中加入稍过量的Na2SO3溶液,将废液中的I2还原为I﹣ , 其离子方程式为该操作将I2还原为I﹣的目的是
-
(2) 操作X的名称为.
-
(3) 氧化时,在三颈烧瓶中将含I﹣的水溶液用盐酸调至pH约为2,缓慢通入Cl2 , 在40℃左右反应(实验装置如图2所示).实验控制在较低温度下进行的原因是;锥形瓶里盛放的溶液为.
-
(4) 已知:5SO32﹣+2IO3﹣+2H+=I2+5SO42﹣+H2O,某含碘废水(pH约为8)中一定存在I2 , 可能存在I﹣、IO3﹣中的一种或两种.请补充完整检验含碘废水中是否含有I﹣、IO3﹣的实验方案:取适量含碘废水用CCl4多次萃取、分液,直到水层用淀粉溶液检验不出有碘单质存在;
.实验中可供选择的试剂:稀盐酸、淀粉溶液、FeCl3溶液、Na2SO3溶液.
有关海水提溴和海带提碘的叙述错误的是( )
A . 都需经过浓缩、氧化、提取
B . 海水提溴的浓缩原理是蒸发
C . 氧化步骤都可通入氯气来实现
D . 提取步骤都可用四氯化碳萃取
大规模开发利用铁、铜、铝,由早到晚的时间顺序是( )
A . 铁、铜、铝
B . 铁、铝、铜
C . 铝、铜、铁
D . 铜、铁、铝
下列有关电化学的装置示意图正确的是 ( )
A . 铜锌原电池  B . 铜锌原电池
B . 铜锌原电池  C . 精炼铜
C . 精炼铜  D . 电解饱和食盐水
D . 电解饱和食盐水 
 B . 铜锌原电池
B . 铜锌原电池  C . 精炼铜
C . 精炼铜  D . 电解饱和食盐水
D . 电解饱和食盐水 
下列有关工业生产的叙述正确的是( )
A . 合成氨生产过程中将NH3液化分离,可加快正反应速率,提高N2、H2的转化率
B . 从海水中可以得到NaCl,工业冶炼金属钠可以通过电解NaCl饱和溶液获得
C . 电解精炼铜时,同一时间内阳极溶解铜的质量比阴极析出铜的质量小
D . 电解饱和食盐水制烧碱,采用离子交换膜法,可防止阴极室产生的Cl2进入阳极室
在硫酸亚铁、硫酸铁和硫酸铜的混合溶液中加入铁粉,充分反应后滤出的不溶物中除铜粉外,还有少量铁粉。那么滤液中( )
A . 一定含有Fe2+ , 可能含有Fe3+
B . 一定含有Fe3+ , 可能含有Cu2+
C . 一定含有Fe2+ , 可能含有Fe3+或Cu2+
D . 一定含有Fe2+ , 一定不含有Fe3+或Cu2+
海水淡化的方法主要有蒸馏法、电渗析法、离子交换法等。离子交换法净化水过程如图所示。下列说法中错误的( )

A . 经过阳离子交换树脂后,水中阳离子的总数不变
B . 水中的  、
、  、Cl- 通过阴离子树脂后被除去
C . 阴离子树脂填充段存在反应 H+ +OH- =H2O
D . 通过净化处理后,水的导电性降低
、Cl- 通过阴离子树脂后被除去
C . 阴离子树脂填充段存在反应 H+ +OH- =H2O
D . 通过净化处理后,水的导电性降低
 、
、  、Cl- 通过阴离子树脂后被除去
C . 阴离子树脂填充段存在反应 H+ +OH- =H2O
D . 通过净化处理后,水的导电性降低
、Cl- 通过阴离子树脂后被除去
C . 阴离子树脂填充段存在反应 H+ +OH- =H2O
D . 通过净化处理后,水的导电性降低
化学与生活息息相关,下列说法错误的是( )
A . “煤改气”“燃煤脱硫”等有利于改善环境
B . 二氧化氯泡腾片遇水产生ClO2用于杀菌消毒
C . “嫦娥五号”使用的氧化铝陶瓷属于金属材料
D . “凡铁分生熟……既炒则熟”指的是氧化除碳
下列说法错误的是( )
A . 金属铝密度小、硬度大,可用于制造飞机等部件
B . 硫酸钡难溶于水,医疗上可用作检查肠胃的内服药剂
C . 工业上可采用高温冶炼黄铜矿的方法获得粗铜
D . 氯化铁、硫酸铁可用做净水剂
海洋的化学资源有十分大的开发潜力。利用海水资源(主要含 、
、 , 少量的
, 少量的 、
、 、
、 、
、 、
、 )制备碳酸锂的一种工艺如图所示:
)制备碳酸锂的一种工艺如图所示:
 、
、 , 少量的
, 少量的 、
、 、
、 、
、 、
、 )制备碳酸锂的一种工艺如图所示:
)制备碳酸锂的一种工艺如图所示:
资料: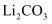 微溶于水,在冷水中溶解度较热水中大,不溶于乙醇。
微溶于水,在冷水中溶解度较热水中大,不溶于乙醇。
下列说法正确的是( )
A . 工序③和工序④顺序可互换
B . 工序⑤选择常温下进行,可降低碳酸锂在水中的溶解度,提高产率
C . 用乙醇洗涤粗产品可起到提高产率和快速干燥的效果
D . 滤渣1和滤渣2的主要成分分别是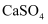 和
和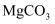
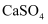 和
和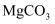
最近更新



