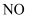第二节 金属的腐蚀和防护 知识点题库
相同材质的铁在图中的四种情况下腐蚀最快的是( )
A . 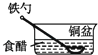 B .
B . 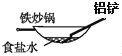 C .
C . 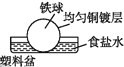 D .
D . 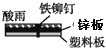
 B .
B .  C .
C .  D .
D . 
工业上用的铝上矿(主要成分是氧化铝.含氧化铁杂质)为原料冶炼铝的工艺流程如下:
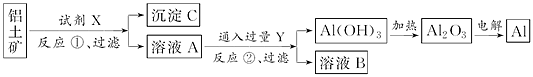
下列叙述正确的是( )
A . 反应①中试剂X是氢氧化钠溶液
B . 试剂Y是HCl,它与AlO2﹣反应生成氢氧化铝
C . 图中所示转化反应中包含2个氧化还原反应
D . 将X与Y试剂进行对换,最终可以达到相同结果
光亮的铁钉在下列几种情况下,最不容易生锈的是( )
A .  B .
B . 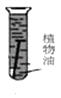 C .
C . 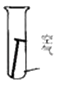 D .
D . 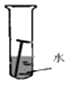
 B .
B .  C .
C .  D .
D . 
对外加电流的金属保护中,被保护的金属( )
A . 与电源的正极相连
B . 表面上发生氧化反应
C . 与电源的负极相连
D . 与另一种活泼性较差的金属相连
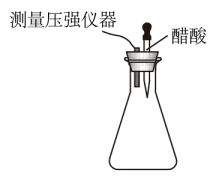
关于如图所示各装置图的叙述不正确的是( ) 

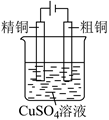
A . 用装置①精炼铜,a极为粗铜,电解质溶液为硫酸铜溶液
B . 装置②盐桥中KCl的Cl﹣ 移向乙烧杯
C . 装置③中钢闸门应与外接电源的负极相连
D . 装置④可以验证温度对化学平衡的影响
在下列环境中,铁制品最容易生锈的是( )
A . 放在纯净的氧气中
B . 放在干燥的空气中
C . 放在潮湿的空气中
D . 浸没在蒸馏水中
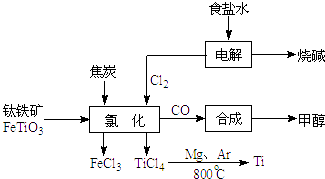
钛(Ti )被称为继铁、铝之后的第三金属.如图所示,将钛厂、氯碱厂和甲醇厂组成产业链可以大大提高资源利用率,减少环境污染.请填写下列空白:
-
(1) 电解饱和食盐水时,总反应的离子方程式是.
-
(2) 根据上面流程写出钛铁矿经氯化法得到四氯化钛的化学方程式.
-
(3) 已知:①Mg(s)+Cl2(g)=MgCl2(s)△H=﹣641kJ•mol﹣1
②Ti(s)+2Cl2(g)=TiCl4(s)△H=﹣770kJ•mol﹣1则2Mg(s)+TiCl4(s)=2MgCl2(s)+Ti(s)△H=.反应2Mg(s)+TiCl4(s)
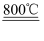 2MgCl2(s)+Ti,在Ar气氛中进行的理由是:.
2MgCl2(s)+Ti,在Ar气氛中进行的理由是:. -
(4) 以甲醇、空气、氢氧化钾溶液为原料,石墨为电极可构成燃料电池.该电池中负极上的电极反应式是
生产、生活中离不开化学知识.下列说法正确的是( )
A . 汽车尾气、工业废气的排放是形成“雾霾”的主要原因
B . 用铝制容器盛放浓硫酸,是因为铝和浓硫酸不反应
C . 不锈钢比普通钢抗腐蚀能力强,是因为表面镀了一层铬
D . “辽宁舰”用于舰载机降落阻拦索的是一种特种钢缆,属于新型无机非金属材料
下列事实不能用电化学理论解释的是 ( )
A . 轮船水线以下的船壳上装一定数量的锌块
B . 铝片不用特殊方法保存
C . 纯锌与稀硫酸反应时,滴入少量硫酸铜溶液后速率加快
D . 镀锌的铁比镀锡的铁耐用
关于钢铁腐蚀与防护的说法不正确的是( )
A . 钢铁的吸氧腐蚀和析氢腐蚀的负极反应式均为Fe-2e-=Fe2+
B . 钢铁发生吸氧腐蚀时,正极反应式为O2+2H2O+4e-=4OH-
C . 地下钢管连接镁块是采用牺牲阳极的阴极保护法
D . 用外加电流的阴极保护法防止钢铁腐蚀时,钢铁接电源的正极
下图所示的实验,能达到实验目的的是( )
A .  验证化学能转化为电能
B .
验证化学能转化为电能
B .  验证温度对化学平衡的影响
C .
验证温度对化学平衡的影响
C . 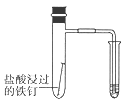 验证铁钉发生吸氧腐蚀
D .
验证铁钉发生吸氧腐蚀
D .  验证AgCl溶解度大于Ag2S
验证AgCl溶解度大于Ag2S
 验证化学能转化为电能
B .
验证化学能转化为电能
B .  验证温度对化学平衡的影响
C .
验证温度对化学平衡的影响
C .  验证铁钉发生吸氧腐蚀
D .
验证铁钉发生吸氧腐蚀
D .  验证AgCl溶解度大于Ag2S
验证AgCl溶解度大于Ag2S
下列事实中,使用牺牲阳极的阴极保护法进行金属防腐的是()
A . 地下钢管连接镁块
B . 金属护栏表面涂漆
C . 汽车底盘喷涂高分子膜
D . 水中的钢闸门连接电源的负极
“中国名片”中航天、军事、天文等领域的发展受到世界瞩目,它们与化学有着密切的联系。下列说法错误的是( )
A . “天宫二号”空间实验室的硅电池板将光能直接转换为电能
B . “蛟龙”号潜水器所使用的钛合金材料具有强度大、密度小、耐腐蚀等特性
C . “歼-20”飞机上大量使用的碳纤维是一种新型有机高分子材料
D . 港珠澳大桥设计使用寿命120年,水下钢柱镶铝块防腐的方法为牺牲阳极保护法
为防止铁管道腐蚀分别采取了如下甲、乙两种方法,下列有关说法错误的是( )
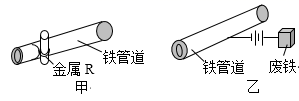
A . 方法甲叫作牺牲阳极保护法,R可以选择Zn、Cu等金属
B . 方法乙叫作外加电流阴极保护法
C . 两种方法的实质均是阻止铁发生氧化反应而腐蚀
D . 在潮湿的酸性土壤中,铁管道主要发生析氢腐蚀
如图所示2套实验装置,分别回答下列问题。
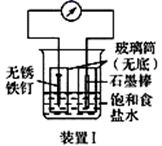

-
(1) 装置Ⅰ为铁的吸氧腐蚀实验。一段时间后,铁被(填“ 氧化”或“还原”); 向插入石墨棒的玻璃筒内滴入酚酞溶液,可观察到石墨附近的溶液变红,该电极反应为。
-
(2) 装置Ⅱ中甲烧杯盛放100 mL 0.2 mol·L-1的NaCl溶液,乙烧杯盛放100 mL 0.5 mol·L-1的CuSO4溶液。反应一段时间后,停止通电。向甲烧杯中滴入几滴酚酞溶液,观察到铁片电极附近首先变红。电源的M端为(填“正”或“负”)极,甲烧杯中铁电极的电极反应为,停止电解,乙中电极质量增加。
港珠澳大桥的建造使用了大量钢材.对钢铁采取的防腐措施合理的是( )
A . 表面镶铜
B . 表面喷涂油漆
C . 用水清洗
D . 增加钢铁中的碳含量
-
(1) 下列说法正确的是_______(填字母序号)。A . 化学反应的实质就是旧化学键的断裂,新化学键的形成,在化学反应中,反应物转化为生成物的同时,必然伴随着能量的变化 B . 钢铁生锈腐蚀时,铁被氧化 C . 放热反应发生时,不一定要加热。但吸热反应必须要加热才能发生
-
(2) 在101 kPa时,2 g H2完全燃烧生成液态水,放出285.8 kJ热量,氢气完全燃烧的热化学方程式表示为。
-
(3) 目前工业上有一种方法是用CO2来生产甲醇:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)。如图1表示该反应进行过程中能量的变化(单位为:kJ·mol-1),该反应是△H0(选填“>”“=”或“<”)。
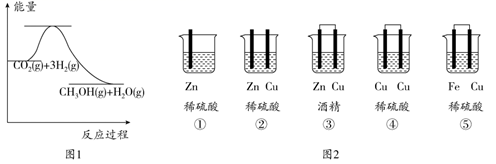
-
(4) 图2装置属于原电池的是(填序号)。在选出的原电池中,是负极,发生(选填“氧化”或“还原”)反应,正极的现象。此原电池反应的化学方程式为。
下列实验装置设计与对应结论正确的是( )
| | | | |
| A.X若为苯,可用于吸收 | B.制取 | C.验证铁发生吸氧腐蚀 | D.电解精炼铜 |
A . A
B . B
C . C
D . D
某研究小组为探究弱酸性条件下铁发生电化学腐蚀类型的影响因素,设计下表实验。将混合均匀的新制铁粉和碳粉置于锥形瓶底部,塞上瓶塞。从胶头滴管中一次性滴入醋酸溶液,同时测量容器中的压强变化。下列说法错误的是( )
编号 | 实验目的 | 碳粉/g | 铁粉/g | 醋酸/ | 醋酸/ |
① | 为以下实验作参照 | 0.5 | 2.0 | 90.0 | 2.0 |
② | 醋酸浓度的影响 | 0.5 | a | 36.0 | 2.0 |
③ | M | 0.2 | 2.0 | 90.0 | 2.0 |
A . 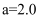 B . M为“碳粉质量的影响”
C . 该实验一共探究了4种影响因素
D . 铁发生电化学腐蚀负极反应为
B . M为“碳粉质量的影响”
C . 该实验一共探究了4种影响因素
D . 铁发生电化学腐蚀负极反应为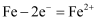
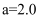 B . M为“碳粉质量的影响”
C . 该实验一共探究了4种影响因素
D . 铁发生电化学腐蚀负极反应为
B . M为“碳粉质量的影响”
C . 该实验一共探究了4种影响因素
D . 铁发生电化学腐蚀负极反应为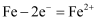
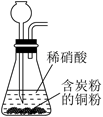
用如图所示装置及试剂进行铁的电化学腐蚀实验探究,测定具支锥形瓶中压强(p)随时间变化关系以及溶解氧(DO)随时间变化关系的曲线如下,下列说法错误的是( )
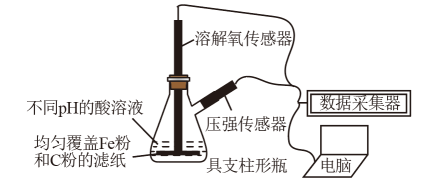
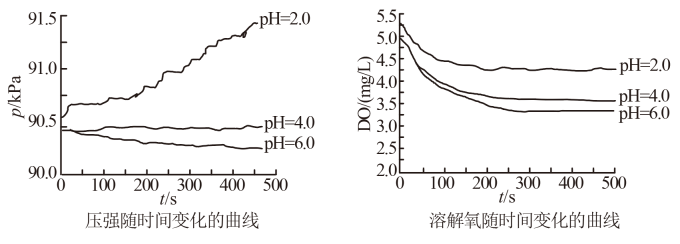
A . 压强增大主要是因为产生了H2
B . 整个过程中,负极电极反应式为Fe-2e-=Fe2+
C . pH=4.0时,不发生析氢腐蚀,只发生吸氧腐蚀
D . pH=2.0时,正极电极反应式为2H++2e-=H2↑和O2+4e-+4H+=2H2O
最近更新


 ,并防止倒吸
,并防止倒吸