第二节 金属的腐蚀和防护 知识点题库
每年世界上钢铁的产量很高,但钢铁腐蚀也给人类带来了巨大的损失,因此如何更好地进行金属防护,一直是科学研究领域中的重要课题。
-
(1) 钢铁在潮湿的空气中的锈蚀主要属于,沿海地区的钢铁腐蚀比内陆地区更严重的原因是。
-
(2) 据环保部门测定,我国一些大城市的酸雨pH=3.5。在酸雨季节铁制品极易腐蚀,则在其腐蚀中正极发生的反应是。
-
(3) 在工业上常用亚硫酸钠除去水中溶解的氧,防止输水管被腐蚀,请简要说明原因。
钢铁很容易生锈而被腐蚀,每年因腐蚀而损失的钢铁占世界钢铁年产量的四分之一.请回答钢铁在腐蚀、防护过程中的有关问题.
-
(1) 钢铁腐蚀主要是吸氧腐蚀,该腐蚀过程的电极反应式为:负极 , 正极 .
-
(2) 下列哪个装置可防止铁棒被腐蚀 .




-
(3) 如果镀层破损后,镀铜铁比镀锌铁更容易被腐蚀,请简要说明原因
最易使钢铁生锈的环境是( )
A . 干燥的空气
B . 潮湿的空气
C . 浸没在水中
D . 浸没在油中
化学与生活密切相关,下列有关说法正确的是( )
A . 在日常生活中,化学腐蚀是造成钢铁腐蚀的主要原因
B . 人造纤维、合成纤维和光导纤维都是有机高分子化合物
C . 推广使用新能源,可以减少二氧化碳等温室气体的排放
D . 塑化剂是一种化工塑料软化剂,可以大量添加到婴幼儿玩具中
下列叙述中,正确的是
①纯铁比碳素钢易生锈
②大量燃烧含硫燃料是形成酸雨的主要原因
③硅是光导纤维和制造太阳能电池的主要原料
④可用稀盐酸、碳酸钠溶液、硅酸钠溶液设计实验来验证元素的非金属性Cl>C>Si
⑤氯水和过氧化钠都具有漂白作用,其漂白原理相似
⑥用氢氟酸雕刻玻璃是利用氢氟酸能与二氧化硅反应的性质
⑦日本福岛核电站泄露的放射性核素13153Ⅰ和13755Cs,前者比后者少8个中子
⑧Al2O3在工业上用于制作耐高温材料,也用于电解法冶炼铝金属( )
A . ①⑤⑥⑦
B . ②③⑤⑦
C . ③④⑤⑥
D . ②⑤⑥⑧
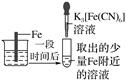
某同学做如表实验:下列说法正确的是( )
装 置 |
|
|
现象 | 电流计指针未发生偏转 | 电流计指针发生偏转 |
A . “电流计指针未发生偏转”,说明铁片Ⅰ、铁片Ⅱ均未被腐蚀
B . 铁片Ⅳ的电极反应式可能为Fe﹣3e﹣=Fe3+
C . 用K3Fe(CN)6]溶液检验铁片Ⅲ、Ⅳ附近溶液,可判断装置的正、负极
D . 铁片Ⅰ、Ⅲ所处的电解质溶液浓度相同,所以二者的腐蚀速率相等
下列说法一定正确的是( )
A . 反应A(s)⇌2B(g)+C(g),当C的体积分数不变时,反应达到平衡状态
B . 将钢闸门与直流电源的正极相连,可防止钢闸门腐蚀
C . 用FeS为沉淀剂除去废水中的Hg2+:FeS(s)+Hg2+(aq)═HgS(s)+Fe2+(aq)
D . 增大反应物浓度可加快反应速率,因此可用浓硫酸与铁反应增大生成氢气的速率
下列关于金属腐蚀的说法中不正确的是( )
A . 金属腐蚀的本质是金属原子失去电子而被氧化
B . 金属腐蚀一般包括化学腐蚀和电化学腐蚀
C . 纯的金属一般难以发生电化学腐蚀
D . 钢铁在酸性环境中会发生吸氧腐蚀
电化学原理在防止金属腐蚀、能量转换、物质合成等方面应用广泛.

-
(1) 为了减缓海水对钢闸门A和C的腐蚀,图1中,材料B可以选择(填字母序号).
a.锌板 b.铜板 c.碳棒
图2中,钢闸门C作极.若用氯化钠溶液模拟海水进行实验,D为石墨块,则D上的电极
反应式为,检测该电极反应产物的试剂是.
-
(2) 微生物电池是指在微生物的作用下将化学能转化为电能的装置,其工作原理如图3所示(质子交换膜只允许H+自由通过).该电池的正极反应式为.
-
(3) 电渗析法处理厨房垃圾发酵液,同时得到乳酸(弱酸)的原理如图4所示(图中“HA”表示乳酸
分子,A﹣表示乳酸根离子).
①阳极的电极反应式为.
②简述浓缩室中得到浓乳酸的原理:.
下图所示水槽中试管内有一枚铁钉,放置数天后观察:

-
(1) 铁钉在逐渐生锈,则铁钉的腐蚀属于腐蚀。
-
(2) 若试管内液面上升,则原溶液呈性,发生腐蚀,正极反应式为。
-
(3) 若试管内液面下降,则原溶液呈性,正极反应式为。
下列说法正确的是( )
A . 在外加电流的阴极保护法中,须将被保护的钢铁设备与直流电源的负极相连
B . 反应H2S(g)+ZnO(s)=H2O(g)+ZnS(s)在一定条件下可自发进行,且ΔS<0,则ΔH>0
C . 常温常压,氢氧燃料电池工作消耗2.24 L O2时,转移电子的数目为0.4×6.02×1023
D . 常温下,Ksp[Cu(OH)2]=2.6×10-19 , pH=10的含Cu2+的溶液中,c(Cu2+)≥2.6×10-11mol·L-1
下列有关说法正确的是( )
A . 在轮船表面涂刷富锌油漆,能有效防止船体在海水中被腐蚀
B . 0.1 mol•L﹣1氨水加水稀释后,溶液中  的值减小
C . 用pH均为2的盐酸和醋酸分别中和等物质的量的NaOH,消耗醋酸的体积更大
D . 反应NH3(g)+HCl(g)═NH4Cl(s)在室温下可自发进行,则该反应的△H>0
的值减小
C . 用pH均为2的盐酸和醋酸分别中和等物质的量的NaOH,消耗醋酸的体积更大
D . 反应NH3(g)+HCl(g)═NH4Cl(s)在室温下可自发进行,则该反应的△H>0
 的值减小
C . 用pH均为2的盐酸和醋酸分别中和等物质的量的NaOH,消耗醋酸的体积更大
D . 反应NH3(g)+HCl(g)═NH4Cl(s)在室温下可自发进行,则该反应的△H>0
的值减小
C . 用pH均为2的盐酸和醋酸分别中和等物质的量的NaOH,消耗醋酸的体积更大
D . 反应NH3(g)+HCl(g)═NH4Cl(s)在室温下可自发进行,则该反应的△H>0
验证牺牲阳极的阴极保护法,实验如下(烧杯内均为经过酸化的3%NaCl溶液)。
| ① | ② | ③ |
| | | |
| 在Fe表面生成蓝色沉淀 | 试管内无明显变化 | 试管内生成蓝色沉淀 |
下列说法错误的是( )
A . 对比②③,可以判定Zn保护了Fe
B . 将Zn换成Cu,用①的方法可判断Fe比Cu活泼
C . 验证Zn保护Fe时不能用①的方法
D . 对比①②,K3[Fe(CN)6]可能将Fe氧化
关于下列各装置图的叙述错误的是( )




A . 用图①装置实现铁上镀铜,a极为铜,电解质溶液可以是CuSO4溶液
B . 图②装置盐桥中KCl的Cl-移向左烧杯
C . 图③装置中钢闸门应与外接电源的负极相连获得保护
D . 图④两个装置中通过导线的电子数相同时,消耗负极材料的物质的量相同
下列关于如图所示的实验装置的判断中错误的是( )
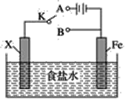
A . 若X为碳棒,开关K置于A处可减缓铁的腐蚀
B . 若X为锌棒,开关K置于A或B处均可减缓铁的腐蚀
C . 若X为锌棒,开关K置于B处时,为牺牲阳极的阴极保护法
D . 若X为碳棒,开关K置于B处时,铁电极上发生的反应为2H++2e-=H2↑
下列事实能用勒夏特列原理解释的是( )
A . 铜与浓硫酸反应需要加热
B . 加热蒸干FeCl3溶液最终得到Fe(OH)3
C . 使用催化剂提高合成氨的生产效率
D . 钢管与铜管堆放一处,钢管更易腐蚀
为探究海水对钢铁的腐蚀,某兴趣小组设计了如下五种装置,铁片在这五种装置中的腐蚀速率由慢到快的顺序为( )

A . ①⑤④③②
B . ③①②①⑤
C . ④③①⑤②
D . ④⑤②①③。
下列解释事实的化学用语,表述错误的是( )
A . NaCl溶液具有导电性:NaCl=Na++Cl-
B . 钠在空气中燃烧生成淡黄色固体:2Na+O2 Na2O2
C . 钢铁在海水中发生吸氧腐蚀的负极反应:Fe-3e-=Fe3+
D . Na2CO3溶液显碱性:CO
Na2O2
C . 钢铁在海水中发生吸氧腐蚀的负极反应:Fe-3e-=Fe3+
D . Na2CO3溶液显碱性:CO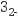 +H2O
+H2O HCO
HCO +OH-
+OH-
 Na2O2
C . 钢铁在海水中发生吸氧腐蚀的负极反应:Fe-3e-=Fe3+
D . Na2CO3溶液显碱性:CO
Na2O2
C . 钢铁在海水中发生吸氧腐蚀的负极反应:Fe-3e-=Fe3+
D . Na2CO3溶液显碱性:CO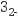 +H2O
+H2O HCO
HCO +OH-
+OH-
下列实验操作正确且能达到实验目的的是( )
选项 | 操作 | 目的 |
A | 将MgCl2溶液加热蒸干 | 由MgCl2溶液制备无水MgCl2 |
B | 将铁钉放入试管中,用盐酸浸没 | 验证铁的吸氧腐蚀 |
C | 称取KMnO4固体0.3160g,放入100mL容量瓶中,加水溶解并稀释至刻度 | 配制浓度为0.0200 |
D | 先从分液漏斗下口放出有机层,后从上口倒出水层 | CCl4萃取分离碘水中的I2 |
A . A
B . B
C . C
D . D
利用小粒径零价铁(ZVI)的电化学腐蚀处理三氯乙烯( )进行水体修复的过程如图所示,水体中的
)进行水体修复的过程如图所示,水体中的 、
、 、
、 等共存物会影响修复效果。下列说法错误的是( )
等共存物会影响修复效果。下列说法错误的是( )
 )进行水体修复的过程如图所示,水体中的
)进行水体修复的过程如图所示,水体中的 、
、 、
、 等共存物会影响修复效果。下列说法错误的是( )
等共存物会影响修复效果。下列说法错误的是( )
A . 若水体酸性较强,则ZVI易发生析氢腐蚀
B . 水体修复过程中溶液的pH保持不变
C . 图中④的电极反应式为 D . 过程中可产生
D . 过程中可产生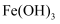 胶体有利于净化水质
胶体有利于净化水质
 D . 过程中可产生
D . 过程中可产生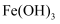 胶体有利于净化水质
胶体有利于净化水质
最近更新




 的KMnO4溶液
的KMnO4溶液


