第二章 化学反应速率和化学平衡 知识点题库
 cC(g)达到平衡时,测得C的浓度c1。增大压强,待各组分的浓度保持恒定时,测得C的浓度为c2。则c1与c2的关系正确的是( )
cC(g)达到平衡时,测得C的浓度c1。增大压强,待各组分的浓度保持恒定时,测得C的浓度为c2。则c1与c2的关系正确的是( )-
(1) 已知:①H2(g)+1/2O2(g)= H2O(l) ΔH1<0;②CO2(g)=CO(g)+1/2O2(g) ΔH2>0;③甲醇的燃烧热为ΔH3。试用ΔH1、ΔH2、ΔH3表示CO(g)+2H2(g)
 CH3OH(l)的ΔH, 则ΔH=__kJ·mol-1。
CH3OH(l)的ΔH, 则ΔH=__kJ·mol-1。
-
(2) 该方法生产甲醇是目前工业上常用的方法。在一定温度下,向2L密闭容器中充入1mol CO和2mol H2 , 发生反应CO(g)+2H2(g)
 CH3OH(g), 5分钟反应达平衡,此时CO的转化率为80%。请回答:
CH3OH(g), 5分钟反应达平衡,此时CO的转化率为80%。请回答:①下列叙述合确的是(填编号)。
A.达到平衡时,移走部分甲醇,平衡将向右移动,正反应速率加快
B.缩小容器的体积,平衡将向右移动,c(CO)将变大
C.在相同的条件下,若使用甲催化剂能使正反应速率加快105倍,使用乙催化剂能使逆反应速率加快108倍,则应该选用乙催化剂
D.若保持平衡时的温度和容积不变,再向容器中充入0.8mol CO和0.6mol CH3OH,则此时v正>v逆
②在方框的坐标系中画出甲醇的物质的量浓度随时间的变化曲线

-
(3) CO2和H2在催化剂Cu/ZnO作用下可发生两个平行反应,分别生成CH3OH和CO。
反应Ⅰ:CO2(g)+3H2(g)=CH3OH(g)+H2O(g)
反应Ⅱ: CO2(g)+H2(g)=CO(g)+H2O(g)
控制CO2和H2初始投料比为1:3时,温度对CO2平衡转化率及甲醇和CO产率的影响如图2所示。

①由图2可知温度升高CO的产率上升,其主要原因可能是。
②由图2可知获取CH3OH最适宜的温度是。
-
(4) 近几年开发的甲醇燃料电池的工作原理如图所示:

电池中的质子交换膜只允许质子和水分子通过,电解质溶液为稀硫酸,则a电极的电极反应式为。
①光催化分解水制氧气:2H2O(l)=2H2(g)+O2(g) ΔH1=+571.6 kJ·mol-1
②过氧化氢分解制氧气:2H2O2(l)=2H2O(l)+O2(g) ΔH2=-196.4 kJ·mol-1
③一氧化氮分解制氧气:2NO(g)=N2(g)+O2(g) ΔH3=-180.5 kJ·mol-1
由此得出的有关推断正确的是( )
乙:在试管中加入2 g颗粒状大理石,加入4 mol/L盐酸20 mL(过量);
下列CO2生成体积(折算成标准状况)V(CO2)同反应时间t的关系曲线图合理的是( )
 B .
B .  C .
C .  D .
D . 
①加H2O②加NaOH固体③滴入几滴浓盐酸④加CuO固体⑤加NaCl溶液⑥滴加几滴硫酸铜溶液⑦升高温度(不考虑盐酸挥发)⑧改用10mL0.1mol·L-1的盐酸
-
(1) 已知:2Al2O3(s)= 4Al(g) +3O2(g) ΔH1=+3351 kJ·molˉ1;
2C(s)+O2(g)= 2CO(g) ΔH2=-221 kJ·molˉ1 ;
2Al(g)+N2(g)= 2AlN(s) ΔH3=-318 kJ·molˉ1
碳热还原Al2O3合成AlN(可逆反应)的总热化学方程式是,该反应自发进行的条件,随着温度升高,反应物Al2O3的平衡转化率将(填“增大”、“不变”或“减小”);一定温度下,在压强为p的反应体系中,平衡时CO的物质的量浓度为c;若温度不变,反应体系的压强减小为0. 5p , 则平衡时CO的物质的量浓度。
A.小于0.5c B.大于0.5c , 小于c C.等于c D.大于c
-
(2) 据文献报道,CO2可以在碱性水溶液中电解生成甲烷,生成甲烷的电极反应式是。
 2AB(g),达到平衡的标志是( )
2AB(g),达到平衡的标志是( )

-
(1) 氯化过程控制电石渣过量,在75℃左右进行。氯化时存在Cl2与Ca(OH)2作用生成Ca(ClO)2的反应,Ca(ClO)2进一步转化为Ca(ClO3)2 , 少量Ca(ClO)2分解为CaCl2和O2。
①生成Ca(ClO)2的化学方程式为。
②提高Cl2转化为Ca(ClO3)2的转化率的可行措施有(填序号)。
A.适当减缓通入Cl2速率 B.充分搅拌浆料 C.加水使Ca(OH)2完全溶解
-
(2) 氯化过程中Cl2转化为Ca(ClO3)2的总反应方程式为6Ca(OH)2+6Cl2=Ca(ClO3)2+5CaCl2+6H2O,氯化完成后过滤。

①滤渣的主要成分为(填化学式)。
②滤液中Ca(ClO3)2与CaCl2的物质的量之比n[Ca(ClO3)2]:n(CaCl2)1:5(填“>”、“<”或“=”)。
-
(3) 向滤液中加入稍过量KCl固体可将Ca(ClO3)2转化为KClO3 , 若溶液中KClO3的含量为100 g▪L-1 , 从该溶液中尽可能多地析出KClO3固体的方法是。
-
(1) I.火法炼铅将铅精矿在空气中焙烧,生成PbO和SO2。
①用铅精矿火法炼铅的反应的化学方程式为。
②火法炼铅的废气中含低浓度SO2 , 可将废气通入过量氨水中进行处理,反应的离子方程式为。
-
(2) II.湿法炼铅在制备金属铅的同时,还可制得硫磺,相对于火法炼铅更为环保。湿法炼铅的工艺流程如图:

已知:①不同温度下PbCl2的溶解度如下表所示。

②PbCl2为能溶于水的弱电解质,在Cl-浓度较大的溶液中,存在平衡:PbCl2(aq)+2Cl-(aq)
 PbCl42-(aq)。
PbCl42-(aq)。铅精矿浸取后“趁热过滤”的原因是。
-
(3) 操作a为加适量水稀释并冷却,该操作有利于滤液1中PbCl2的析出。试分析“加适量水稀释”可能的原因是。
-
(4) 将溶液3和滤液2分别置于如图所示电解装置的两个极室中,可制取金属铅并使浸取液中的FeCl3再生。

①溶液3应置于(填“阴极室”或“阳极室”)中。
②滤液2电解后可实现FeCl3的再生,该电极的电极反应式。
③若铅精矿的质量为ag,铅浸出率为b,当电解池中通过cmol电子时,金属铅全部析出,铅精矿中PbS的质量分数为(用a、b、c的代数式表示)。
Ⅰ. 

Ⅱ. 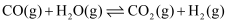

Ⅲ. 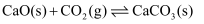

Ⅳ. 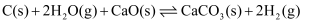
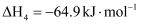
副反应:
Ⅴ. 
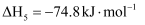
Ⅵ. 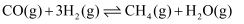

回答下列问题:
-
(1) 已知反应Ⅰ、Ⅱ的平衡常数
 、
、  随温度的变化如图1、图2所示。
随温度的变化如图1、图2所示。 

①由反应Ⅴ和反应Ⅵ可知,
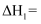 ;反应Ⅰ的
;反应Ⅰ的 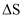 (填“
(填“  ”或“
”或“ 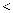 ”)0。
”)0。②温度小于
 时,
时, 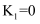 ,原因是。
,原因是。③为提高反应Ⅱ中
 的转化率,可采取的措施是(写一条)
的转化率,可采取的措施是(写一条)④
 时,向密闭容器中充入
时,向密闭容器中充入 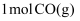 和
和  ,只发生反应Ⅱ,此时该反应的平衡常数
,只发生反应Ⅱ,此时该反应的平衡常数  ,
,  的平衡转化率为。
的平衡转化率为。 -
(2) 从环境保护角度分析,该制氢工艺中设计反应Ⅲ的优点是。
-
(3) 起始时在气化炉中加入
 、
、  及
及  ,在
,在  下,气体的组成与温度的关系如图3所示。
下,气体的组成与温度的关系如图3所示。 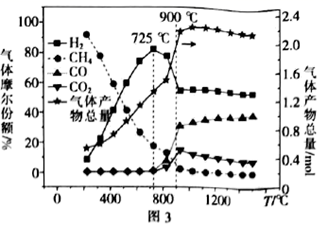
①
 时,
时,  的量不断减少的原因是。
的量不断减少的原因是。②
 时,
时,  的物质的量分数快速减小,其原因是。
的物质的量分数快速减小,其原因是。③制氢生产中控制温度为
 左右,不采用
左右,不采用 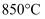 以上温度的原因是。
以上温度的原因是。
 3C(g),∆H<0,向一恒温恒容的密闭容器中充入1molA和3molB发生反应,t1时达到平衡状态I,在t2时改变某一条件,t3时重新达到平衡状态Ⅱ,正反应速率随时间的变化如图所示。下列说法正确的是( )
3C(g),∆H<0,向一恒温恒容的密闭容器中充入1molA和3molB发生反应,t1时达到平衡状态I,在t2时改变某一条件,t3时重新达到平衡状态Ⅱ,正反应速率随时间的变化如图所示。下列说法正确的是( ) 
 ,
, 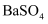 均难溶于水,
均难溶于水, , 离子浓度
, 离子浓度 时认为其沉淀完全。
时认为其沉淀完全。 时,
时, ,
, 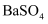 的沉淀溶解平衡曲线如图所示,其中
的沉淀溶解平衡曲线如图所示,其中 ,
, 
 或
或 。下列叙述正确的是( )
。下列叙述正确的是( )
 时,
时, 的数量级为
的数量级为 B .
B .  时,
时, 点对应为
点对应为 的饱和溶液
C .
的饱和溶液
C .  时,
时, 的平衡常数
的平衡常数 D .
D .  时,向浓度均为
时,向浓度均为 的
的 和
和 的混合溶液中加入
的混合溶液中加入 溶液,当
溶液,当 恰好完全沉淀时,溶液中
恰好完全沉淀时,溶液中
 , 甲醇水蒸气重整制得的氢是用于驱动电动汽车的燃料电池的理想氢源。
, 甲醇水蒸气重整制得的氢是用于驱动电动汽车的燃料电池的理想氢源。甲醇水蒸气重整过程的反应历程如下:
甲醇分解反应: (慢反应)
(慢反应)
水煤气变换反应: (快反应)
(快反应)
-
(1) 在T℃、100MPa下,将
 和
和 充入放有催化剂的5L恒容密闭容器中反应。经过足够长的时间后,测得
充入放有催化剂的5L恒容密闭容器中反应。经过足够长的时间后,测得 的含量极小。
的含量极小。 、
、 、
、 、
、 的物质的量与时间的关系如图所示。
的物质的量与时间的关系如图所示。
①曲线a、d对应的物质的化学式分别是、。
②0~12min内,曲线c表示的物质的反应速率为(保留两位有效数字)
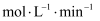 。
。 -
(2) 一定温度下,向容积为2L的恒容密闭容器中充入
 , 只发生反应
, 只发生反应 , 经tmin后,
, 经tmin后, 的物质的量浓度减小
的物质的量浓度减小 。
。①tmin时,CO的物质的量为(填表达式,下同)mol;
 内,
内, 的反应速率为
的反应速率为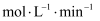 。
。②下列能判断反应已达到平衡状态的是(填标号)。
A.CO与
 的物质的量之比为1∶2
的物质的量之比为1∶2B.
 的转化率为100%
的转化率为100%C.CO、
 、
、 的物质的量浓度均不再发生变化
的物质的量浓度均不再发生变化D.用同种物质表示的正反应速率等于逆反应速率且不为0
-
(3) 一款以甲醇为燃料的原电池的结构如图。

①空气进入的电极为(填“正”或“负”)极。
②写出电池工作时负极的电极反应式:。
③若电池工作时转移0.01mol电子,理论上消耗mL(标准状况)
 。
。
 ,还含有
,还含有  及钠、铝、铜的氧化物等杂质),一种以锆矿石为原料制备工业纯
及钠、铝、铜的氧化物等杂质),一种以锆矿石为原料制备工业纯  的工艺流程如图所示:
的工艺流程如图所示: 
已知:  易溶于水,390℃会升华;
易溶于水,390℃会升华;  难溶于水,受热易分解。
难溶于水,受热易分解。
回答下列问题:
-
(1) 为使氯化得更充分,一般采用的措施有(只填一条)。
-
(2) “高温氯化”过程中,
 的产率与温度的关系如图所示,试分析随温度升高
的产率与温度的关系如图所示,试分析随温度升高  产率降低的原因:;“高温氯化”结束前会通一段时间氧气,其目的是。
产率降低的原因:;“高温氯化”结束前会通一段时间氧气,其目的是。 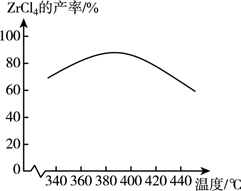
-
(3) “高温氯化”可以把氧化物转化为氯化物,写出
 在“高温氯化”时发生反应的化学方程式:。
在“高温氯化”时发生反应的化学方程式:。
-
(4) “过量的NaOH稀溶液”的作用是;得到“溶液1”的操作名称为,该操作所用的玻璃仪器有。
-
(5) “溶液2”中含
 ,写出生成该离子的离子方程式:。
,写出生成该离子的离子方程式:。
-
(1) 红热木炭与浓H2SO4反应的化学方程式是C+2H2SO4
 CO2↑+2SO2↑+2H2O,该反应中浓硫酸的作用是作(填“氧化剂”或“还原剂”)。
CO2↑+2SO2↑+2H2O,该反应中浓硫酸的作用是作(填“氧化剂”或“还原剂”)。
-
(2) SO2能够使品红溶液褪色,体现了二氧化硫具有性(填“漂白性”或“还原性”)。
-
(3) 关于氮的变化关系图如下:

上述流程中能够实现氮的固定的是(填“Ⅰ”“Ⅱ”或“Ⅲ”)。
-
(4) 氨的催化氧化是工业上制硝酸的重要步骤,其反应为:4NH3(g)+5O2(g)
 4NO(g)+6H2O(g)。
4NO(g)+6H2O(g)。①一定条件下,在体积10 L的密闭容器中进行,半分钟后,NO的物质的量增加了4.5 mol,则此反应的平均速率v(NH3)=mol·(L·s)-1;
②在相同温度下,向该容器中通入一定量的NH3气体,反应速率将(填“加快”“减慢”或“不变”)。
 2SCl2(g)。Cl2 与 SCl2 的消耗速率(v)与温度(T)的关系如图所示,以下说法中错误的是( )
2SCl2(g)。Cl2 与 SCl2 的消耗速率(v)与温度(T)的关系如图所示,以下说法中错误的是( )
 经历两步:①X→Y;②Y→2Z。反应体系中X、Y、Z的浓度c随时间t的变化曲线如图所示。下列说法错误的是( )
经历两步:①X→Y;②Y→2Z。反应体系中X、Y、Z的浓度c随时间t的变化曲线如图所示。下列说法错误的是( )
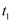 时,
时, C .
C .  时,Y的消耗速率小于生成速率
D .
时,Y的消耗速率小于生成速率
D .  后,
后,



