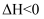第еӣӣиҠӮ еҢ–еӯҰеҸҚеә”иҝӣиЎҢзҡ„ж–№еҗ‘ зҹҘиҜҶзӮ№йўҳеә“

-
пјҲ1пјү зӣ®еүҚе·ҘдёҡдёҠжңүдёҖз§Қж–№жі•жҳҜз”ЁCO2жқҘз”ҹдә§зҮғж–ҷз”ІйҶҮгҖӮдёәжҺўз©¶еҸҚеә”еҺҹзҗҶпјҢзҺ°иҝӣиЎҢеҰӮдёӢе®һйӘҢпјҢеңЁдҪ“з§Ҝдёә1 Lзҡ„еҜҶй—ӯе®№еҷЁдёӯпјҢе……е…Ҙ1mol CO2е’Ң3mol H2 пјҢ дёҖе®ҡжқЎд»¶дёӢеҸ‘з”ҹеҸҚеә”пјҡCO2(g)пјӢ3H2(g)
 CH3OH(g)пјӢH2O(g) в–іHпјқпјҚ49.0kJ/molпјҢжөӢеҫ—CO2е’ҢCH3OH(g)зҡ„жө“еәҰйҡҸж—¶й—ҙеҸҳеҢ–еҰӮеӣҫжүҖзӨәгҖӮ
CH3OH(g)пјӢH2O(g) в–іHпјқпјҚ49.0kJ/molпјҢжөӢеҫ—CO2е’ҢCH3OH(g)зҡ„жө“еәҰйҡҸж—¶й—ҙеҸҳеҢ–еҰӮеӣҫжүҖзӨәгҖӮ 
в‘ д»ҺеҸҚеә”ејҖе§ӢеҲ°е№іиЎЎпјҢж°ўж°”зҡ„е№іеқҮеҸҚеә”йҖҹзҺҮv(H2)пјқmol/(LВ·min)гҖӮ
в‘ЎиҜҘеҸҚеә”зҡ„е№іиЎЎеёёж•°иЎЁиҫҫејҸдёәK=гҖӮ
в‘ўдёӢеҲ—жҺӘж–ҪдёӯиғҪдҪҝn(CH3OH)пјҸn(CO2)еўһеӨ§зҡ„жҳҜгҖӮ
A.еҚҮй«ҳжё©еәҰ
B.е……е…ҘHe(g)пјҢдҪҝдҪ“зі»еҺӢејәеўһеӨ§
C.е°ҶH2O(g)д»ҺдҪ“зі»дёӯеҲҶзҰ»
D.еҶҚе……е…Ҙ1mol CO2е’Ң3mol H2
-
пјҲ2пјү жңүдәәжҸҗеҮәпјҢеҸҜд»Ҙи®ҫи®ЎеҸҚеә”2CO(g)пјқ2C(s)пјӢO2(g) йҖҡиҝҮе…¶иҮӘеҸ‘иҝӣиЎҢжқҘж¶ҲйҷӨCOзҡ„жұЎжҹ“гҖӮиҜҘж–№жЎҲ(еЎ«вҖңжҳҜвҖқгҖҒвҖңеҗҰвҖқ)еҸҜиЎҢпјҢзҗҶз”ұжҳҜпјҡгҖӮ
| t/в„ғ | 700 | 800 | 830 | 1 000 | 1 200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
еӣһзӯ”дёӢеҲ—й—®йўҳпјҡ
-
пјҲ1пјү иҜҘеҸҚеә”зҡ„еҢ–еӯҰе№іиЎЎеёёж•°иЎЁиҫҫејҸдёәKпјқгҖӮ
-
пјҲ2пјү иҜҘеҸҚеә”дёә(еЎ«вҖңеҗёзғӯвҖқжҲ–вҖңж”ҫзғӯвҖқ)еҸҚеә”гҖӮ
-
пјҲ3пјү иғҪеҲӨж–ӯиҜҘеҸҚеә”иҫҫеҲ°еҢ–еӯҰе№іиЎЎзҠ¶жҖҒзҡ„дҫқжҚ®жҳҜ________гҖӮA . е®№еҷЁдёӯеҺӢејәдёҚеҸҳ B . ж··еҗҲж°”дҪ“дёӯc(CO)дёҚеҸҳ C . П…жӯЈ(H2)пјқП…йҖҶ(H2O) D . c(CO2)пјқc(CO)
-
пјҲ4пјү жҹҗжё©еәҰдёӢпјҢе№іиЎЎжө“еәҰз¬ҰеҗҲдёӢејҸпјҡc(CO2)В·c(H2)пјқc(CO)В·c(H2O)пјҢиҜ•еҲӨж–ӯжӯӨж—¶зҡ„жё©еәҰдёәв„ғгҖӮ
-
пјҲ5пјү еңЁ800в„ғж—¶пјҢеҸ‘з”ҹдёҠиҝ°еҸҚеә”пјҢжҹҗдёҖж—¶еҲ»жөӢеҫ—е®№еҷЁеҶ…еҗ„зү©иҙЁзҡ„жө“еәҰеҲҶеҲ«дёәc(CO2)дёә2molВ·LпјҚ1 пјҢ c(H2)дёә1.5molВ·LпјҚ1 пјҢ c(CO)дёә1molВ·LпјҚ1 пјҢ c(H2O)дёә3molВ·LпјҚ1 пјҢ еҲҷдёӢдёҖж—¶еҲ»пјҢеҸҚеә”еҗ‘(еЎ«вҖңжӯЈеҗ‘вҖқжҲ–вҖңйҖҶеҗ‘вҖқ)иҝӣиЎҢгҖӮ
 2SO3(g)в–іHпјқпјҚQkJВ·molпјҚ1пјҲQпјһ0пјүпјҢеҲҷе°Ҷ2mol SO2(g) е’Ң1mol O2(g) зҪ®дәҺдёҖеҜҶй—ӯе®№еҷЁдёӯе……еҲҶеҸҚеә”еҗҺж”ҫеҮәQ kJзҡ„зғӯйҮҸ
D . зЁҖжә¶ж¶Ідёӯ1mol NaOHеҲҶеҲ«е’Ң1mol CH3COOHгҖҒ1molHNO3еҸҚеә”пјҢдёӨиҖ…ж”ҫеҮәзҡ„зғӯйҮҸдёҖж ·еӨҡ
2SO3(g)в–іHпјқпјҚQkJВ·molпјҚ1пјҲQпјһ0пјүпјҢеҲҷе°Ҷ2mol SO2(g) е’Ң1mol O2(g) зҪ®дәҺдёҖеҜҶй—ӯе®№еҷЁдёӯе……еҲҶеҸҚеә”еҗҺж”ҫеҮәQ kJзҡ„зғӯйҮҸ
D . зЁҖжә¶ж¶Ідёӯ1mol NaOHеҲҶеҲ«е’Ң1mol CH3COOHгҖҒ1molHNO3еҸҚеә”пјҢдёӨиҖ…ж”ҫеҮәзҡ„зғӯйҮҸдёҖж ·еӨҡ
 2CO2(g)+4H2O(1) в–іH<0пјҢдёӢеҲ—иҜҙжі•жӯЈзЎ®зҡ„жҳҜпјҲ пјү
2CO2(g)+4H2O(1) в–іH<0пјҢдёӢеҲ—иҜҙжі•жӯЈзЎ®зҡ„жҳҜпјҲ пјү
-
пјҲ1пјү IпјҺз”ІйҶҮиЈӮи§ЈеҲ¶ж°ўжі•
иҜҘж–№жі•зҡ„дё»еҸҚеә”пјҡCH3OH(g)
 CO(g)+2H2(g) в–іH1>0жӯӨеҸҚеә”иғҪиҮӘеҸ‘иҝӣиЎҢзҡ„еҺҹеӣ жҳҜгҖӮ
CO(g)+2H2(g) в–іH1>0жӯӨеҸҚеә”иғҪиҮӘеҸ‘иҝӣиЎҢзҡ„еҺҹеӣ жҳҜгҖӮ -
пјҲ2пјү дёҖе®ҡжё©еәҰдёӢпјҢеҗ‘жҹҗдёҖеҲҡжҖ§жҒ’е®№еҜҶй—ӯе®№еҷЁдёӯе……е…ҘCH3OH(g)пјҢеҸ‘з”ҹеҸҚеә”CH3OH(g)
 CO(g)+2H2(g)пјҢеҸҚеә”иө·е§Ӣж—¶CH3OH(g)зҡ„еҺӢејәдёә5.00MPaпјҢt hеҗҺеҸҚеә”иҫҫеҲ°е№іиЎЎпјҢжӯӨж—¶H2зҡ„зү©иҙЁзҡ„йҮҸеҲҶж•°дёә60%пјҢеҲҷ0~t hеҶ…зҡ„е№іеқҮеҸҚеә”йҖҹзҺҮv(CO)=MPaвҖўh-1 пјҢ CH3OHзҡ„е№іиЎЎиҪ¬еҢ–зҺҮОұ(CH3OH)=пјҢжӯӨж—¶е№іиЎЎеёёж•°Kp=(Kpдёәд»Ҙе№іиЎЎеҲҶеҺӢиЎЁзӨәзҡ„е№іиЎЎеёёж•°пјүгҖӮ
CO(g)+2H2(g)пјҢеҸҚеә”иө·е§Ӣж—¶CH3OH(g)зҡ„еҺӢејәдёә5.00MPaпјҢt hеҗҺеҸҚеә”иҫҫеҲ°е№іиЎЎпјҢжӯӨж—¶H2зҡ„зү©иҙЁзҡ„йҮҸеҲҶж•°дёә60%пјҢеҲҷ0~t hеҶ…зҡ„е№іеқҮеҸҚеә”йҖҹзҺҮv(CO)=MPaвҖўh-1 пјҢ CH3OHзҡ„е№іиЎЎиҪ¬еҢ–зҺҮОұ(CH3OH)=пјҢжӯӨж—¶е№іиЎЎеёёж•°Kp=(Kpдёәд»Ҙе№іиЎЎеҲҶеҺӢиЎЁзӨәзҡ„е№іиЎЎеёёж•°пјүгҖӮ
-
пјҲ3пјү з§‘з ”дәәе‘ҳйҖҡиҝҮи®Ўз®—жңәжЁЎжӢҹз”ЁPd(III)еӮ¬еҢ–з”ІйҶҮиЈӮи§Јзҡ„еҸҚеә”жңәзҗҶпјҢеҫ—еҲ°йҷ„зқҖеңЁPd(III)иЎЁйқўдёҠз”ІйҶҮеҸҳжҚўзҡ„еҸҚеә”еҺҶзЁӢеӣҫпј»еҰӮеӣҫ1пјҢйҷ„еңЁPd(III)иЎЁйқўзҡ„зү©з§Қз”ЁпјҠж ҮжіЁпјҪпјҢжӯӨеҺҶзЁӢдёӯжҙ»еҢ–иғҪжңҖе°Ҹзҡ„еҸҚеә”ж–№зЁӢејҸдёәгҖӮ

-
пјҲ4пјү IIпјҺз”ІйҶҮж°ҙи’ёж°”йҮҚж•ҙеҲ¶ж°ўжі•
иҜҘж–№жі•зҡ„йғЁеҲҶеҸҚеә”еҰӮдёӢпјҡ
дё»еҸҚеә”пјҡCH3OH(g)+H2O(g)
 CO2(g)+3H2(g) в–іH2=+49kJвҖўmol-1
CO2(g)+3H2(g) в–іH2=+49kJвҖўmol-1еүҜеҸҚеә”пјҡH2(g)+CO2(g)
 CO(g)+H2O(g) в–іH3=-41kJВ·mol-1
CO(g)+H2O(g) в–іH3=-41kJВ·mol-1в‘ зӣёеҗҢжқЎд»¶дёӢпјҢз”ІйҶҮж°ҙи’ёж°”йҮҚж•ҙеҲ¶ж°ўжі•дёҺз”ІйҶҮиЈӮи§ЈеҲ¶ж°ўжі•зӣёжҜ”иҫғпјҢд»Һз»ҸжөҺж•ҲзӣҠе’Ңз»ҝиүІеҢ–еӯҰи§’еәҰеҲҶжһҗпјҢеүҚиҖ…е…Ҳиҝӣд№ӢеӨ„еңЁдәҺгҖӮ
в‘ЎеңЁжҹҗеӮ¬еҢ–еүӮзҡ„дҪңз”ЁдёӢпјҢеңЁзӣёеҗҢж—¶й—ҙеҶ…пјҢдёҚеҗҢжё©еәҰдёӢжөӢеҫ—CH3OHзҡ„иҪ¬еҢ–зҺҮгҖҒCOзҡ„з”ҹжҲҗзҺҮдёҺжё©еәҰзҡ„еҸҳеҢ–е…ізі»еҰӮеӣҫ2жүҖзӨәгҖӮ

йҡҸзқҖжё©еәҰзҡ„еҚҮй«ҳпјҢCH3OHе®һйҷ…еҸҚеә”иҪ¬еҢ–зҺҮдёҚж–ӯжҺҘиҝ‘е№іиЎЎзҠ¶жҖҒиҪ¬еҢ–зҺҮзҡ„еҺҹеӣ жҳҜпјҲеЎ«еӯ—жҜҚпјүгҖӮ
AпјҺдё»еҸҚеә”зҡ„жҙ»еҢ–иғҪйҷҚдҪҺ
BпјҺдё»еҸҚеә”зҡ„еҸҚеә”йҖҹзҺҮеўһеӨ§
CпјҺCH3OHзҡ„е№іиЎЎиҪ¬еҢ–зҺҮйҷҚдҪҺ
йҡҸзқҖжё©еәҰзҡ„еҚҮй«ҳпјҢCOзҡ„е®һйҷ…еҸҚеә”з”ҹжҲҗзҺҮжІЎжңүдёҚж–ӯжҺҘиҝ‘е№іиЎЎзҠ¶жҖҒз”ҹжҲҗзҺҮзҡ„еҺҹеӣ жҳҜгҖӮдёәжҸҗй«ҳCH3OHзҡ„иҪ¬еҢ–зҺҮдё”дҪҝеүҜеҸҚеә”дёҚеҗ‘жӯЈеҸҚеә”ж–№еҗ‘иҝӣиЎҢпјҢеҸҜйҮҮеҸ–зҡ„жҺӘж–ҪжңүпјҲд»»еҶҷдёҖжқЎпјүгҖӮ