第四节 化学反应进行的方向 知识点题库
(Ⅰ)汽车内燃机工作时发生的反应N2(g)+O2(g)═2NO(g)△H=+180.8kJ•mol﹣1是导致汽车尾气中含有NO的重要原因之一.
(1)有人欲选用合适的催化剂,使反应2NO(g)═N2(g)+O2(g)能较快进行以达到除去NO的目的.你认为该反应能否自发进行 (填“能”或“不能”).
(2)利用催化技术可将汽车尾气中的NO气体转化成无毒气体,相关反应的平衡常数可表示为
K= , 此反应为放热反应.在一定温度下,10L某密闭容器中发生上述反应,各物质的物质的量的变化情况如下表:
, 此反应为放热反应.在一定温度下,10L某密闭容器中发生上述反应,各物质的物质的量的变化情况如下表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 | 6 |
c(NO)/mol | 1.00 | 0.450 | 0.250 | 0.150 | 0.100 | 0.100 | 0.092 |
c(CO)/mol | 3.600 | 3.050 | 2.850 | 2.750 | 2.700 | 2.700 | 2.692 |
c(N2)/mol | 0 | 0.275 | 0.375 | 0.425 | 0.450 | 0.450 | 0.454 |
c(CO2)/mol | 0 | 0.550 | 0.750 | 0.850 | 0.900 | 0.900 |
①根据土表数据计算0~4s间用NO表示的平均速率v(NO)= ;达到化学平衡时两种反应物的转化率是否相等 (填“相等”或“不相等”).
②在5~6s时,若K增大,5s后正反应速率 (填“增大”或“减小”).
③在5~6s时,若K不变,以上各物质的物质的量变化原因可能是
A选用更有效的催化剂 B.缩小容器的体积 C.降低CO2浓度 D.升高温度
(Ⅱ)为探究硫在氧气中燃烧的产物里是否有SO3 , 某化学兴趣小组在绝热环境下进行了定量实验探究.探究实验的相关数据如下:
生成SO2的质量(g) | 生成SO2的质量(g) | |
3g硫在空气中燃烧 | 5.64~5.70 | 0.375~0.45 |
3g硫在纯氧气中燃烧 | 5.82~5.88 | 0.15~0.225 |
(3)对数据进行分析可知,等质量的硫在纯氧中燃烧产生的SO3比在空气中燃烧产生的SO3少 (填“多”或“少”),原因可能是
A.纯氧中氧气浓度高,有利于化学平衡2SO2(g)+O2⇌2SO3(g)△H=Q kJ•mol﹣1向右移动
B.化学反应2SO2(g)+O2⇌2SO3(g)△H=Q kJ•mol﹣1中的Q<0
C.纯氧中氧气浓度高,单位时间内发热量大,致使反应体系的温度较高,不利于化学平衡
2SO2(g)+O2⇌2SO3(g)△H=Q kJ•mol﹣1向右移动
D.3g硫在纯氧中燃烧比3g硫在空气中燃烧放出的热量多,不利于化学平衡
2SO2(g)+O2⇌2SO3(g)△H=Q kJ•mol﹣1向右移动.
①反应NH3(g)+HCl(g) = NH4Cl(s)在室温下可自发进行,则该反应的ΔH>0
②CaCO3(s) ══ CaO(s)+CO2(g)室温下不能自发进行,说明该反应的ΔH<0
③一定温度下,反应MgCl2(l)=Mg(l)+Cl2(g)的ΔH>0、ΔS>0
④常温下,反应C(s)+CO2(g) =2CO(g)不能自发进行,则该反应的ΔH>0
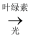 C6H12O6+6O2 ,该变化中光能直接转变为化学能
C . CO2(g)+C(s)
C6H12O6+6O2 ,该变化中光能直接转变为化学能
C . CO2(g)+C(s)  4NO2(g) + O2(g) △H=+56.7kJ/mol,能自发进行的合理解释是( )
4NO2(g) + O2(g) △H=+56.7kJ/mol,能自发进行的合理解释是( )
 2H2(g)+2CO(g),压缩容器体积,平衡转化率将增大
B . H2S(g) +CO2(g)
2H2(g)+2CO(g),压缩容器体积,平衡转化率将增大
B . H2S(g) +CO2(g)  H2O(g)+COS(g),通入CO2 , 将促进反应的进行
C . 已知2H2S(g)+CH4(g)
H2O(g)+COS(g),通入CO2 , 将促进反应的进行
C . 已知2H2S(g)+CH4(g)  4H2(g)+CS2(g) △H>0,则该反应在高温下易自发
D . 2H2S(g)
4H2(g)+CS2(g) △H>0,则该反应在高温下易自发
D . 2H2S(g)  2H2(g)+S(g) △H>0
2H2(g)+S(g) △H>0
-
(1) 已知下列热化学方程式:
CH4(g)+CO2(g)=2CO(g)+2H2(g) △H1=+260kJ/mol
2CO(g)+O2(g)=2CO2(g) △H2=-566kJ/mol
请写出用CH4与O2反应生成CO和H2的的热化学方程式。
-
(2) 在一定体积的密闭容器中,进行如下化学反应:N2(g)+3H2(g)
 2NH3(g),其化学平衡常数K与t的关系如下表,请完成下列问题:
2NH3(g),其化学平衡常数K与t的关系如下表,请完成下列问题: t/K
298
398
498
K/(mol/L)-2
4.1×106
K1
K2
①比较K1、K2的大小,K1K2(填写“>”“=”或“<”)。
②下列各项能作为判断该反应达到化学平衡状态的依据的是(填序号字母)。
A.容器内N2、H2、NH3的浓度之比为1:3:2 B.3v(N2)(正)=v(H2)(逆)
C.容器内压强保持不变 D.混合气体的密度保持不变
③若上述反应达到平衡时,N2、H2、NH3的浓度之比为1:3:2,再向容器中按物质的量之比1:3:2通入N2、H2、NH3 , 与原平衡相比,N2的物质的量浓度(填“增大”或“减小”或“不变”,下同),NH3的体积分数。
-
(3) 高炉炼铁中发生的基本反应之一如下:FeO(s)+CO(g)
 Fe(s)+CO2(g) △H>0。
Fe(s)+CO2(g) △H>0。 ①其平衡常数可表示为。
②已知1100℃时K=0.263,1100℃时测得高炉中c(CO2)=0.025 mol/L,c(CO)=0.1mol/L,此时CO气体的转化率为(用百分数表示),该反应是否处于化学平衡状态(选填“是”或“否”),此时,化学反应速率是υ正υ逆(选填“大于”、“小于”或“等于”)。
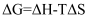 (设
(设 、
、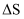 不随温度变化),当
不随温度变化),当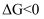 时反应能自发进行。反应
时反应能自发进行。反应 的自发情况是( )
的自发情况是( )
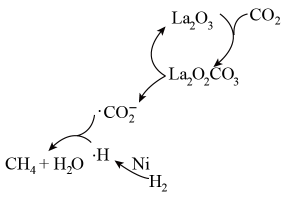
 CH4+2H2O。CO2与氢气反应制CH4的一种催化机理如图所示,下列说法正确的是( )
CH4+2H2O。CO2与氢气反应制CH4的一种催化机理如图所示,下列说法正确的是( )