第四节 化学反应进行的方向 知识点题库
下列说法正确的是( )
A . △H>0的反应,常温下一定不能自发进行
B . 用0.1mol/LNaOH溶液分别滴定相同物质的量浓度和相同体积的盐酸和醋酸,其中实线表示的是滴定盐酸的曲线
C . 常温下,在0.1mol/L氨水中,加入少量NH4Cl晶体,溶液的pH减小
D . 恒容密闭容器中进行的反应3A(g)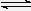 2B(g)+C(s),在其它条件不变的情况下,再充入一定量的A气体,A的转化率不变
2B(g)+C(s),在其它条件不变的情况下,再充入一定量的A气体,A的转化率不变
 2B(g)+C(s),在其它条件不变的情况下,再充入一定量的A气体,A的转化率不变
2B(g)+C(s),在其它条件不变的情况下,再充入一定量的A气体,A的转化率不变
某反应2AB(g)⇌C(g)+3D(g)在高温时能自发进行,其逆反应在低温下能自发进行,则该反应的正反应的△H、△S应为( )
A . △H>0,△S>0
B . △H<0,△S<0
C . △H<0,△S>0
D . △H>0,△S<0
下列反应一定能自发进行的是( )
A . 放热反应
B . 熵增加的反应
C . 熵增加的吸热反应
D . 熵增加的放热反应
下列叙述不正确的是( )
A . 铁生锈、白磷燃烧均为自发放热过程
B . 冰融化过程其熵值增大
C . 高温高压下可以使石墨转化为金刚石是自发的化学反应
D . 同一物质固态时熵值最小
二甲醚(CH3OCH3)是一种清洁、高效、具有优良的环保性能的可燃物,被称为21世纪的新型能源.工业制备二甲醚的生产流程如图1:
催化反应室中(压力2.0~10.0Mpa,温度300℃)进行下列反应:
①CO(g)+2H2(g)⇌CH3OH(g)△H=﹣90.7kJ/mol
②2CH3OH(g)⇌CH3OCH3(g)+H2O(g)△H=﹣23.5kJ/mol
③CO(g)+H2O(g)⇌CO2(g)+H2(g)△H=﹣41.2kJ/mol
(1)催化反应室中总反应3CO(g)+3H2(g)⇌CH3OCH3(g)+CO2(g)的△H=
据此可判断该反应 条件下自发.
(2)在温度和容积不变的条件下发生反应①,能说明该反应达到平衡状态的依据是
a.容器中压强保持不变b.混合气体中c (CO)不变
c.V正(CO)=V逆(H2) d.c (CO3OH)=c (CO)
(3)在2L的容器中加入amolCH3OH(g)发生反应②,达到平衡后若再加入amolCH3OH(g)重新达到平衡时,CH3OH的转化率 (填“增大”、“减小”或“不变”).
(4)850℃时在一体积为10L的容器中通入一定量的CO和H2O(g)发生反应③,CO和H2O(g)浓度变化如图2所示①0~4min的平均反应速率V(CO)=
②若温度不变,向该容器中加入4molCO(g)、2molH2O(g)、3molCO2(g)和3molH2(g),起始时V正 V逆(填“<”、“>”或“=”),请结合必要的计算说明理由
(5)上述工艺制备流程中二甲醚精制的实验操作名称为

下列说法中正确的是( )
A . 能自发进行的反应一定能迅速发生反应
B . 非自发进行的反应一定不可能发生反应
C . 能自发进行的反应实际可能没有发生反应
D . 常温下,2H2O  2H2↑+O2↑,即常温下水的分解反应是自发反应
2H2↑+O2↑,即常温下水的分解反应是自发反应
 2H2↑+O2↑,即常温下水的分解反应是自发反应
2H2↑+O2↑,即常温下水的分解反应是自发反应
关于自发反应的叙述正确的是 ( )
A . 常温下的自发反应一定是不需要条件就能自发的反应,因此氮气和氢气合成氨气的反应在常温下不能自动发生
B . 常温下自然界发生的任何反应都是自发反应,光合作用是自发反应
C . 电解水在通常状况下是非自发反应,因此水在任何条件下生成氢气和氧气均为非自发反应
D . 某个反应是放热、熵增大的反应,该反应一定能自发进行
已知;(NH4)2CO3(s)═NH4HCO3(s)+NH3(g) △H=+74.9kJ·mol﹣1 , 下列说法中正确的是( )
A . 该反应是吸热反应,因此一定不能自发进行
B . 该反应熵增,所以一定可以自发进行
C . 该反应中ΔS>0、所以高温可以自发进行
D . 自发进行的反应可能是放热反应,不能自发进行的反应都是吸热反应
下列说法错误的是( )
A . 一定温度下的焓变在数值上等于变化过程中的等容热效应
B . 升高温度,活化分子百分数增大,化学反应速率一定增大
C . 熵增加且放热的反应一定是自发反应
D . 常温下硝酸铵能够溶于水,因为其溶于水是一个熵增大过程
在体积均为1.0 L的两恒容密闭容器中加入足量的相同的碳粉,再分别加入0.1 mol CO2和0.2 mol CO2 , 在不同温度下反应CO2(g)+C(s)  2CO(g)达到平衡,平衡时CO2的物质的量浓度c(CO2)随温度的变化如图所示(图中Ⅰ、Ⅱ、Ⅲ点均处于曲线上)。下列说法正确的是(双选)( )
2CO(g)达到平衡,平衡时CO2的物质的量浓度c(CO2)随温度的变化如图所示(图中Ⅰ、Ⅱ、Ⅲ点均处于曲线上)。下列说法正确的是(双选)( )
 2CO(g)达到平衡,平衡时CO2的物质的量浓度c(CO2)随温度的变化如图所示(图中Ⅰ、Ⅱ、Ⅲ点均处于曲线上)。下列说法正确的是(双选)( )
2CO(g)达到平衡,平衡时CO2的物质的量浓度c(CO2)随温度的变化如图所示(图中Ⅰ、Ⅱ、Ⅲ点均处于曲线上)。下列说法正确的是(双选)( ) 
A . 反应CO2(g)+C(s)  2CO(g)的ΔS>0、ΔH<0
B . 体系的总压强p总:p总(状态Ⅱ)>2p总(状态Ⅰ)
C . 体系中c(CO):c(CO,状态Ⅱ)<2c(CO,状态Ⅲ)
D . 逆反应速率:v逆(状态Ⅰ)>v逆(状态Ⅲ)
2CO(g)的ΔS>0、ΔH<0
B . 体系的总压强p总:p总(状态Ⅱ)>2p总(状态Ⅰ)
C . 体系中c(CO):c(CO,状态Ⅱ)<2c(CO,状态Ⅲ)
D . 逆反应速率:v逆(状态Ⅰ)>v逆(状态Ⅲ)
 2CO(g)的ΔS>0、ΔH<0
B . 体系的总压强p总:p总(状态Ⅱ)>2p总(状态Ⅰ)
C . 体系中c(CO):c(CO,状态Ⅱ)<2c(CO,状态Ⅲ)
D . 逆反应速率:v逆(状态Ⅰ)>v逆(状态Ⅲ)
2CO(g)的ΔS>0、ΔH<0
B . 体系的总压强p总:p总(状态Ⅱ)>2p总(状态Ⅰ)
C . 体系中c(CO):c(CO,状态Ⅱ)<2c(CO,状态Ⅲ)
D . 逆反应速率:v逆(状态Ⅰ)>v逆(状态Ⅲ)
下列关于能量判据和熵判据的说法中,错误的是( )
A . 放热的自发过程可能是熵减小的过程,吸热的自发过程一定为熵增加的过程
B . 放热过程(ΔH<0)或熵增加(ΔS>0)的过程一定是自发的
C . 在室温下碳酸钙的分解反应不能自发进行,但同样是这个吸热反应在较高温度(1200 K)下则能自发进行
D . 由能量判据(以焓变为基础)和熵判据组合成的复合判据,将更适合于所有的过程
对于反应4Fe(OH)2(s)+O2(g)+2H2O(l)=4Fe(OH)3(s) △H= - 444.3kJ/mol,在常温常压下能自发进行,对反应的方向起决定性作用的是( )
A . 焓变
B . 温度
C . 压强
D . 熵变
某反应2AB(g)  C(g)+3D(g)在高温时能自发进行,其逆反应在低温下能自发进行,则该反应的ΔH、ΔS应为( )
C(g)+3D(g)在高温时能自发进行,其逆反应在低温下能自发进行,则该反应的ΔH、ΔS应为( )
 C(g)+3D(g)在高温时能自发进行,其逆反应在低温下能自发进行,则该反应的ΔH、ΔS应为( )
C(g)+3D(g)在高温时能自发进行,其逆反应在低温下能自发进行,则该反应的ΔH、ΔS应为( )
A . ΔH <0,ΔS>0
B . ΔH <0,ΔS<0
C . ΔH >0,ΔS>0
D . ΔH >0,ΔS<0
下列说法中正确的是( )
A . CaCO3(s)=CaO(s)+CO2(g)在室温下不能自发进行,说明该反应的△H>0
B . -10℃的水结成冰,可用熵判据来解释反应的自发性
C . 能自发进行的反应一定能迅速发生
D . △H<0、△S>0的反应在低温时一定不能自发进行
下列有关说法中正确的是( )
A . 2CaCO3(s)+2SO2(g)+O2(g)=2CaSO4(s)+2CO2(g)在低温下能自发进行,则该反应的ΔH < 0
B . 反应NH4Cl(s)=NH3(g)+HCl(g)的ΔS < 0
C . 若ΔH > 0,ΔS < 0,化学反应在任何温度下都能自发进行
D . 加入合适的催化剂能降低反应活化能,从而改变反应的焓变
以下过程在常温下都可以自发进行,可用焓判据来解释的是( )
A . 硝酸铵自发地溶于水
B . 湿的衣服经过晾晒变干
C . 2N2O5(g)=4NO2(g)+O2(g) ΔH = + 56.7 kJ/mol
D . 2H2(g)+O2(g)=2H2O(l) ΔH=-571.6 kJ/mol
在25 ℃,1.01×105Pa条件下,反应2N2O5(g)=4NO2(g)+O2(g) △H= +56.7kJ/mol能自发进行的合理解释是( )
A . 该反应是熵减反应
B . 该反应是分解反应
C . 该反应的焓变效应大于熵变效应
D . 该反应的熵变效应大于焓变效应
反应CH3OH(g) + NH3(g)=CH3NH2(g) + H2O(g)在高温下才能自发向右进行,则该反应的ΔH、ΔS应为( )
A . ΔH>0、ΔS<0
B . ΔH<0、ΔS>0
C . ΔH>0、ΔS>0
D . ΔH<0、ΔS<0
已知当△H-T·△S<0时化学反应能自发进行。下列化学反应肯定能自发进行的是( )
A . N2(g)+3H2(g)⇌2NH3(g)
B . 2K(s)+2H2O(l)=2K+(aq)+2OH-(aq)+H2↑
C . 2Mg(s)+O2(g)=2MgO(s)
D . CaCO3(s)=CaO(s)+CO2(g)
下列关于焓变 和熵变
和熵变 的说法正确的是( )
的说法正确的是( )
 和熵变
和熵变 的说法正确的是( )
的说法正确的是( )
A .  的反应一定能自发进行
B .
的反应一定能自发进行
B .  的反应一定能自发进行
C .
的反应一定能自发进行
C .  的反应能自发进行
D .
的反应能自发进行
D .  的反应一定没有进行
的反应一定没有进行
 的反应一定能自发进行
B .
的反应一定能自发进行
B .  的反应一定能自发进行
C .
的反应一定能自发进行
C .  的反应能自发进行
D .
的反应能自发进行
D .  的反应一定没有进行
的反应一定没有进行
最近更新



