第三章 水溶液中的离子平衡 知识点题库
化学反应 | 平衡常数 | 温度℃ | |
500 | 800 | ||
①2H2(g)+CO(g) | K1 | 2.5 | 0.15 |
②H2(g)+CO2(g) | K2 | 1.0 | 2.50 |
③3H2(g)+CO2(g) | K3 | ||
-
(1) 据反应①与②可推导出K1、K2与K3之间的关系,则K3=(用K1、K2表示)。500℃时测得反应③在某时刻,H2(g)、CO2(g)、CH3OH(g)、H2O (g)的浓度(mol/L)分别为0.8、0.1、0.3、0.15, 则此时 V正 V逆(填“ > ”、“=”或“<”)。
-
(2) 在3 L容积可变的密闭容器中发生反应②,已知c(CO)-反应时间t变化曲线Ⅰ如图所示,若在t0时刻分别改变一个条件,曲线Ⅰ变为曲线Ⅱ和曲线Ⅲ。当曲线Ⅰ变为曲线Ⅱ时,改变的条件是。当曲线Ⅰ变为曲线Ⅲ时,改变的条件是。

-
(3) 一定条件下甲醇与一氧化碳反应可以合成乙酸。通常状况下, 将a mol/L的醋酸与b mol/LBa(OH)2溶液等体积混合,反应平衡时,2c(Ba2+)= c(CH3COO-),用含a和b的代数式表示该混合溶液中醋酸的电离常数为。
-
(4) (Ⅱ)已知草酸是一种二元弱酸,草酸氢钠(NaHC2O4)溶液显酸性。
①常温下,向10 mL 0.01 mol·L-1 H2C2O4溶液中滴加10mL 0.01mol·L-1 NaOH溶液时,比较溶液中各种离子浓度的大小关系 ;
②称取6.0g含H2C2O4·2H2O、KHC2O4和K2SO4的试样,加水溶解配成250 mL 溶液。量取两份此溶液各25 mL,分别置于两个锥形瓶中。第一份溶液中加入2滴酚酞试液,滴加0.25mol·L-1 NaOH 溶液至20mL时,溶液由无色变为浅红色。第二份溶液滴加0.10 mol·L-1 酸性KMnO4溶液至16mL时反应完全。则原试样中H2C2O4·2H2O的的质量分数为 。
 H3O++S2-
B . CH3COOH 溶液加水稀释后,溶液中
H3O++S2-
B . CH3COOH 溶液加水稀释后,溶液中  的值减小
C . 将pH =4的盐酸稀释后,溶液中所有离子的浓度均降低
D . 100℃时,pH=12的纯碱溶液中:c(OH-)=1.0×10-2 mol·L-1
的值减小
C . 将pH =4的盐酸稀释后,溶液中所有离子的浓度均降低
D . 100℃时,pH=12的纯碱溶液中:c(OH-)=1.0×10-2 mol·L-1
| 选项 | 实验操作 | 现象 | 结论 |
| A. | 将SO2通入酸性高锰酸钾溶液 | 高锰酸钾溶液紫色褪色 | SO2具有漂白性 |
| B. | 等体积pH=3的HA和HB两种酸分别与足量的锌反应 | 相同时间内HA与Zn反应生成的氢气更多 | HA是强酸 |
| C. | 灼烧某白色粉末 | 火焰呈黄色 | 白色粉末中含有Na+ , 无K+ |
| D. | 将稀硫酸滴入碳酸钠溶液中产生的气体通入硅酸钠溶液中 | 有白色沉淀生成 | 证明非金属性S>C>Si |
 Al(OH)3+3H+
D . 粗铜(含Cu及少量Zn、Fe、Ag等)电解精炼时,阳极主要发生反应:Ag-e-=Ag+
Al(OH)3+3H+
D . 粗铜(含Cu及少量Zn、Fe、Ag等)电解精炼时,阳极主要发生反应:Ag-e-=Ag+

 2AgCl(s)+CrO42-(aq)的平衡常数K=2.5×107
2AgCl(s)+CrO42-(aq)的平衡常数K=2.5×107
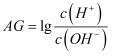 。室温下,实验室里用0.1 mol·L-1 的盐酸滴定10 mL 0.1 mol·L-1 MOH溶液,滴定曲线如图所示。下列说法正确的是:( )
。室温下,实验室里用0.1 mol·L-1 的盐酸滴定10 mL 0.1 mol·L-1 MOH溶液,滴定曲线如图所示。下列说法正确的是:( ) 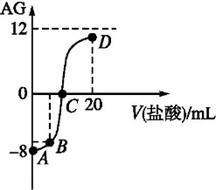
-
(1) 已知 0.1mol/L NaHS 溶液显碱性,则c(S2—)c(H2S)(填“>”“<”或“=”)。
-
(2) 常温下,向 0.2mol/L的 H2S溶液中逐滴滴入 0.2mol/L NaOH 溶液至中性,此时溶液中以下所示关系错误的是___(填字母)。A . c(H+)·c(OH-)=1×10-14 B . c(Na+)=c(HS-)+2c(S2-) C . c(Na+)> c(HS-)+c(S2-)+ c(H2S) D . c(H2S)> c(S2-)
-
(3) 已知常温下,CaS 饱和溶液中存在平衡CaS(s)
 Ca2+(aq)+S2-(aq) △H>0。
Ca2+(aq)+S2-(aq) △H>0。
①温度升高时,KSP(CaS ) = (填“增大”“减少”或“不变”,下同)。
②滴加少量浓盐酸时,c(Ca2+ ),原因是(用文字和离子方程式说明)。
③若向CaS 饱和溶液中加入Cu(NO3)2 溶液中,生成一种黑色固体物质,写出该过程中反应的离子方程式:。
 B . 当滴入氨水10mL时,
B . 当滴入氨水10mL时,  C . 当滴入氨水20mL时,
C . 当滴入氨水20mL时,  D . 当溶液呈中性时,氨水滴入量大于20mL,c(
D . 当溶液呈中性时,氨水滴入量大于20mL,c(  )>c(Cl-)
)>c(Cl-)
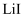 )在能源、医药等领域有重要应用,某兴趣小组制备
)在能源、医药等领域有重要应用,某兴趣小组制备  和
和 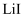 ,流程如下:
,流程如下: 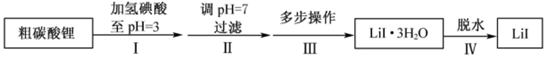
已知:  在75~80℃转变成
在75~80℃转变成 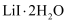 ,80~120℃转变成
,80~120℃转变成  ,300℃以上转变成无水
,300℃以上转变成无水 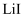 。
。
b. 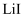 易溶于水,溶解度随温度升高而增大。
易溶于水,溶解度随温度升高而增大。
c. 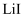 在空气中受热易被氧化。
在空气中受热易被氧化。
请回答:
-
(1) 步骤II,调
 ,为避免引入新的杂质,适宜加入的试剂为。
,为避免引入新的杂质,适宜加入的试剂为。
-
(2) 步骤III,包括蒸发浓缩、冷却结晶、过滤、洗涤、干燥等多步操作。
下列说法正确的是________。
A . 为得到较大的 晶体颗粒,宜用冰水浴快速冷却结晶
B . 为加快过滤速度,得到较干燥的晶体,可进行抽滤
C . 宜用热水洗涤
D . 可在80℃鼓风干燥
晶体颗粒,宜用冰水浴快速冷却结晶
B . 为加快过滤速度,得到较干燥的晶体,可进行抽滤
C . 宜用热水洗涤
D . 可在80℃鼓风干燥
-
(3) 步骤IV,脱水方案为:将所得
 置入坩埚中,300℃加热,得
置入坩埚中,300℃加热,得 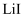 样品。用沉淀滴定法分别测定所得
样品。用沉淀滴定法分别测定所得  、
、 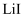 样品纯度,测定过程如下:称取一定量样品,溶解,定容于容量瓶,将容量瓶中的溶液倒入烧杯,用移液管定量移取烧杯中的溶液加入锥形瓶,调
样品纯度,测定过程如下:称取一定量样品,溶解,定容于容量瓶,将容量瓶中的溶液倒入烧杯,用移液管定量移取烧杯中的溶液加入锥形瓶,调 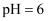 ,用滴定管中的
,用滴定管中的  标准溶液滴定至终点,根据消耗的
标准溶液滴定至终点,根据消耗的  标准溶液体积计算,得
标准溶液体积计算,得  、
、 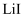 的纯度分别为99.96%,95.38%。
的纯度分别为99.96%,95.38%。 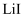 纯度偏低。
纯度偏低。 ①上述测定过程提及的下列仪器,在使用前一定不能润洗的是。
A.容量瓶 B.烧杯 C.锥形瓶 D.滴定管
②测定过程中使用到移液管,选出其正确操作并按序列出字母:
蒸馏水洗涤→待转移溶液润洗→→→→→洗净,放回管架。
a.移液管尖与锥形瓶内壁接触,边吹气边放液
b.放液完毕,停留数秒,取出移液管
c.移液管尖与锥形瓶内壁接触,松开食指放液设备
d.洗耳球吸溶液至移液管标线以上,食指堵住管口
e.放液完毕,抖动数下,取出移液管
f.放液至凹液面最低处与移液管标线相切,按紧管口
③
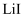 纯度偏低,可能的主要杂质是。
纯度偏低,可能的主要杂质是。
-
(4) 步骤IV,采用改进的实验方案(装置如图),可以提高
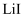 纯度。
纯度。 ①设备X的名称是。
②请说明采用该方案可以提高
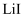 纯度的理由。
纯度的理由。
 的性质与氨相似,25℃时向
的性质与氨相似,25℃时向 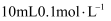 的甲胺中逐滴滴入
的甲胺中逐滴滴入  稀盐酸。溶液中水电离出的氢离子浓度的负对数[用pC表示,
稀盐酸。溶液中水电离出的氢离子浓度的负对数[用pC表示,  ]与加入盐酸体积的关系如图所示。下列叙述错误的是( )
]与加入盐酸体积的关系如图所示。下列叙述错误的是( ) 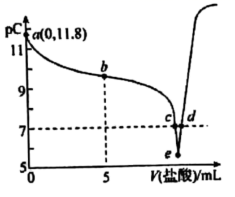
 的数量级为
的数量级为  B . 甲胺的电离方程式:
B . 甲胺的电离方程式: 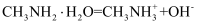 C . b点溶液中甲胺的电离程度大于盐酸甲胺的水解程度
D . e点溶液:
C . b点溶液中甲胺的电离程度大于盐酸甲胺的水解程度
D . e点溶液: 
| 选项 | 实验 | 现象 | 结论 |
| A | 将铝丝和铜丝接触,并放入冷的浓硝酸中浸泡一段时间 | 铝丝上有红棕色气体产生 | 形成了原电池,且负极反应为Cu﹣2e﹣═Cu2+ |
| B | 向亚硫酸钠固体中加入浓硫酸,将产生的气体通入溴水中 | 溴水褪色 | SO2具有漂白性 |
| C | 向某溶液中加入稀硝酸酸化的Ba(NO3)2溶液,再加入AgNO3溶液 | 开始无现象,后有沉淀生成 | 原溶液中一定含有Cl﹣ |
| D | 将盐酸和大理石反应生成的CO2气体直接通入Na2SiO3溶液中 | 产生白色沉淀 | 证明酸性:碳酸>硅酸 |
 保持不变
保持不变
 ]常用作食品稳定剂和抑霉剂。设
]常用作食品稳定剂和抑霉剂。设  为阿伏加德罗常数值。
为阿伏加德罗常数值。 关于常温下  的
的 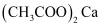 溶液,下列说法正确的是( )
溶液,下列说法正确的是( )
 的数目为0.2
的数目为0.2  B . 稀释溶液,则溶液的pH增大
C .
B . 稀释溶液,则溶液的pH增大
C . 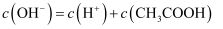 D .
D . 
 时,
时,  的溶度积分别为
的溶度积分别为  .下列说法正确的是( )
.下列说法正确的是( )
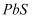 C . 在硫化铜悬浊液中滴加几滴
C . 在硫化铜悬浊液中滴加几滴 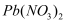 溶液,会生成
溶液,会生成 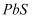 沉淀
D . 向含
沉淀
D . 向含  均为
均为  的溶液中通入
的溶液中通入  气体,产生沉淀的顺序依次为
气体,产生沉淀的顺序依次为 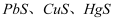
 的盐酸分别滴定20.00mL浓度均为
的盐酸分别滴定20.00mL浓度均为 三种一元弱酸的钠盐
三种一元弱酸的钠盐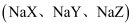 溶液,滴定曲线如图所示。下列判断不正确的是( )
溶液,滴定曲线如图所示。下列判断不正确的是( )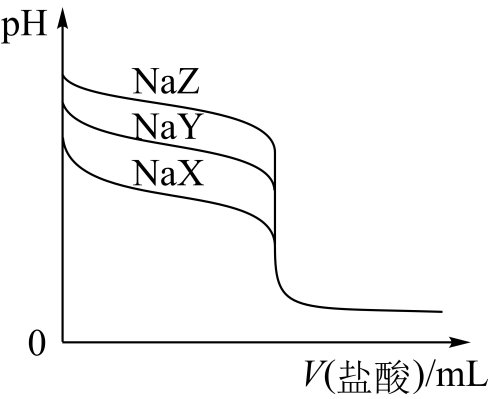
 溶液中:
溶液中: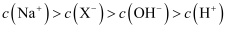 B . 三种一元弱酸的电离常数:
B . 三种一元弱酸的电离常数: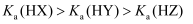 C . 当
C . 当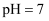 时,三种溶液中:
时,三种溶液中: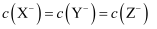 D . 分别滴加20.00mL盐酸后,再将三种溶液混合:
D . 分别滴加20.00mL盐酸后,再将三种溶液混合:
实验现象 | 反应过程中的pH和电导率变化对比曲线 |
滴加氨水时,先不断产生浅蓝色沉淀;后来沉淀逐渐溶解,得到深蓝色溶液。 滴加硫酸时,先不断产生浅蓝色沉淀;后来沉淀逐渐溶解,得到蓝色溶液。 |
|
资料:ⅰ.实验中产生的浅蓝色沉淀为碱式硫酸铜,化学式为Cu2(OH)2SO4;
ⅱ.电导率是以数字表示的溶液中传导电流的能力。
下列分析中错误的是( )
 Cu(OH)2+2H+
B . ab段发生的主要反应为:2Cu2++SO
Cu(OH)2+2H+
B . ab段发生的主要反应为:2Cu2++SO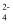 +2NH3·H2O=Cu2(OH)2SO4↓+2NH
+2NH3·H2O=Cu2(OH)2SO4↓+2NH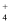 C . d点混合溶液pH<7,与反应后生成的NH
C . d点混合溶液pH<7,与反应后生成的NH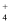 水解有关
D . 根据a′b′与b′c′ 段曲线变化趋势,说明溶液的电导率仅与反应前后离子的浓度和离子所带电荷数有关
水解有关
D . 根据a′b′与b′c′ 段曲线变化趋势,说明溶液的电导率仅与反应前后离子的浓度和离子所带电荷数有关




