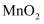实验1-1 蓝瓶子实验 知识点题库
请回答下列问题:
-
(1) 下图所示装置用于制备绿矾。其中锥形瓶中盛放的药品或原料是,集气瓶的作用是;烧杯中主要发生:①CuSO4+H2S=CuS↓+H2SO4 , ②4CuSO4+PH3+4H2O=H3PO4+4H2SO4+4Cu,则烧杯中盛放的试剂是,其作用是。

-
(2) 下图所示装置用于制备硫酸亚铁铵。在0~60 ℃的温度范围内,硫酸亚铁铵在水中的溶解度比硫酸铵、硫酸亚铁的溶解度小,冷却混合液至室温便析出硫酸亚铁铵。具体操作:①打开活塞,关闭活塞,从分液漏斗滴入6 mol·L-1H2SO4到250 mL锥形瓶,充分反应。②待锥形瓶中的铁屑快反应完时,关闭活塞,打开活塞。③放置一段时间,试剂瓶底部将结晶出硫酸亚铁铵。

-
(3) 在制备硫酸亚铁的过程中,理论上控制铁过量或酸过量均有利于防止Fe2+被氧化。设计两个实验:实验一,控制酸过量;实验二,控制铁过量;其余步骤相同,制得硫酸亚铁铵,并对产品质量进行检测。检测结果如下:
序号
反应物用量
产品质量
1
n(H2SO4)∶n(Fe)>1∶1
介于Ⅰ级~Ⅱ级之间
2
n(H2SO4)∶n(Fe)<1∶1
优于Ⅰ级
已知产品质量标准:Fe3+的质量分数等于0.005%,产品质量定为Ⅰ级;Fe3+的质量分数等于0.01%,产品质量定为Ⅱ级,从实验结果中,可得出制备硫酸亚铁溶液时,反应控制过量为最佳。
-
(1) 实验室有如下仪器:①试管 ②烧杯 ③量筒 ④蒸发皿 ⑤坩埚 ⑥温度计 ⑦蒸馏烧瓶,其中可以直接加热的玻璃仪器有(填序号)
-
(2) 4.5g水与 g磷酸(H3PO4)所含的分子数相等,它们所含的氧原子数之比是.
①烧杯 ②坩埚 ③烧瓶 ④试管 ⑤锥形瓶.
-
(1) 如图所示的装置在实验室中用途比较广泛:

①排空气法收集气体,若收集CO2气体,进气口为 (填“a”或“b”)。
②若瓶中装满水,可用于收集下列气体中的(选填编号)。
A、NO B、NO2 C、NH3 D、HCl
此时进气口为(填“a”或“b”)。
③如果广口瓶中盛放浓硫酸,可用作气体干燥装置,则该装置不可以干燥的气体有(选填编号)。
A、HCl B、NH3 C、H2 D、CO
④此装置还可用于除去气体中的杂质气体。若要用此装置除去CO2中混有的少量SO2气体,则装置中应盛放的液体可能是(选填编号)。
A、NaOH溶液 B、饱和Na2CO3溶液 C、饱和NaHCO3溶液 D、浓H2SO4
-
(2) 下面是中学化学实验中常见的几种仪器:
A.量筒 B.容量瓶 C.试管 D.圆底烧瓶 E.托盘天平
①其中仪器上要标出使用温度的是(填选项)
②可用作反应容器并能进行加热的是(填选项)
③下列操作,使得实验结果偏小的是(填选项)
A.称取5.2 gNaCl固体时,将砝码放在左盘,NaCl固体放在右盘
B.配制一定物质的量浓度的NaCl溶液,转移NaCl溶液前,容量瓶中已有少许蒸馏水
C. 配制一定物质的量浓度的NaCl溶液,定容时俯视读数。
D.用量筒量取一定体积的浓硫酸,浓硫酸倒入烧杯后,用蒸馏水继续冲洗量筒内壁并将洗涤液倒入烧杯。

已知:氢化钙遇水剧烈反应。
下列说法正确的是( )
 B .
B .  C .
C .  D .
D . ![]() +2KMnO4
+2KMnO4 ![]() +KOH+2MnO2 +H2O
+KOH+2MnO2 +H2O
![]() +HCl
+HCl ![]() +KCl
+KCl
反应试剂、产物的物理常数:
| 名称 | 相对分 子质量 | 性状 | 熔点 | 沸点 | 密度 | 溶解度 | ||
| 水 | 乙醇 | 乙醚 | ||||||
| 甲苯 | 92 | 无色液体易燃易挥发 | -95 | 110.6 | 0.8669 | 不溶 | 易溶 | 易溶 |
| 苯甲酸 | 122 | 白色片状或针状晶体 | 122.4 | 248 | 1.2659 | 微溶 | 易溶 | 易溶 |
主要实验装置和流程如下:
下图回流搅拌装置

下图抽滤装置

实验方法:一定量的甲苯和KMnO4溶液置于图1装置中,在90℃时, 反应一段时间,再停止反应,按如下流程分离出苯甲酸和回收未反应的甲苯。

-
(1) 无色液体A的结构简式为。操作Ⅱ为。
-
(2) 如果滤液呈紫色,要先加亚硫酸氢钾,然后再加入浓盐酸酸化,加亚硫酸氢钾的目的是。
-
(3) 下列关于仪器的组装或者使用正确的是__________。A . 抽滤可以加快过滤速度,得到较干燥的沉淀 B . 安装电动搅拌器时,搅拌器下端不能与三颈烧瓶底、温度计等接触 C . 回流搅拌装置应采用直接加热的方法 D . 冷凝管中水的流向是下进上出
-
(4) 除去残留在苯甲酸中的甲苯应先加入,分液,水层再加入,然后抽滤,干燥即可得到苯甲酸。
-
(5) 纯度测定:称取1.220g产品,配成100ml溶液,取其中25.00ml溶液,进行滴定 ,消耗KOH物质的量为2.4×10-3mol。产品中苯甲酸质量分数为。
-
(1) Ⅰ.下图所示是分离混合物时常用的仪器,回答下列问题:
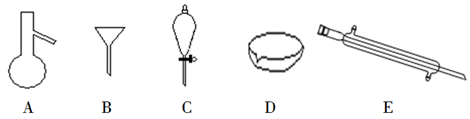
写出仪器C、E的名称分别是、。
-
(2) 若向C装置中加入碘水和足量CCl4 , 充分振荡后静置,观察到现象是:C内液体分两层,上层液体呈色,下层液体呈色。
-
(3) 碘单质和溴单质有相类似的性质,都可以用有机溶剂萃取水溶液中的单质,若利用C仪器提取溴水中的溴单质,下列有机溶剂中不能选用的是_____________(填字母)。A . 汽油 B . CCl4 C . 酒精 D . 苯
-
(4) Ⅱ.配制一定物质的量浓度的溶液是化学实验室的基本实验操作之一。请回答下列问题:
配制0.5 mol/L的硫酸溶液450 mL,需用量筒量取质量分数98%、密度1.84 g/cm3的浓硫酸的体积为mL,如果实验室有15 mL、20 mL、50 mL 量筒,应最好选用mL量筒。
-
(5) 配制上述溶液,除用到量筒、烧杯、玻璃棒外,还需要的两种玻璃仪器是。
-
(6) 关于容量瓶的四种叙述:①是配制准确浓度溶液的仪器;②不宜贮存溶液;③不能用来加热;④使用之前要检查是否漏水。这些叙述中正确的是__________(填字母)。A . ①②③④ B . ②③ C . ①②④ D . ②③④
-
(7) 配制时,其正确的操作顺序是(用字母表示,每个操作只用一次)。
A.用少量水洗涤烧杯2次~3次,洗涤液均注入容量瓶,振荡
B.在盛有水的烧杯中加入浓硫酸稀释
C.将烧杯中已冷却的溶液沿玻璃棒注入容量瓶中
D.将容量瓶盖紧,反复上下颠倒,摇匀
E.改用胶头滴管加水,使溶液凹液面恰好与刻度相切
F.继续往容量瓶内小心加水,直到液面接近刻度1 cm~2 cm处
-
(8) 下面操作造成所配稀硫酸溶液浓度偏高的是___________(填序号)。A . 浓硫酸稀释后溶液没有冷却到室温就转移 B . 转移时没有洗涤烧杯、玻璃棒 C . 向容量瓶加水定容时眼睛俯视液面 D . 用量筒量浓硫酸后洗涤量筒并将洗涤液转移到容量瓶 E . 摇匀后发现液面低于刻度线,又加蒸馏水至刻度线
| 选项 | 实验目的 | 仪器 |
| A | 从食盐水中获得NaCl晶体 | 坩埚、玻璃棒、酒精灯、泥三角 |
| B | 除去氢氧化铝胶体中的泥沙 | 漏斗(带滤纸)、烧杯、玻璃棒 |
| C | 用0.1000 mol·L-1盐酸测定未知浓度的NaOH溶液浓度 | 碱式滴定管、酸式滴定管、锥形瓶、 胶头滴管、烧杯 |
| D | 用MnO2和浓盐酸反应制取干燥、 纯净的Cl2 | 圆底烧瓶、分液漏斗、酒精灯、洗气瓶、集气瓶、导管、石棉网 |
 C .
C . ![]() +KMnO4→
+KMnO4→ 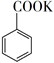 + MnO2
+ MnO2 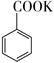 +HCl→
+HCl→ 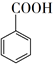 +KCl
+KCl
|
名称 |
相对分 子质量 |
熔点/℃ |
沸点/℃ |
密度/(g·mL−1) |
溶解性 |
|
甲苯 |
92 |
−95 |
110.6 |
0.867 |
不溶于水,易溶于乙醇 |
|
苯甲酸 |
122 |
122.4(100℃左右开始升华) |
248 |
—— |
微溶于冷水,易溶于乙醇、热水 |
实验步骤:①在装有温度计、冷凝管和搅拌器的三颈烧瓶中加入1.5 mL甲苯、100 mL水和4.8 g(约0.03 mol)高锰酸钾,慢慢开启搅拌器,并加热回流至回流液不再出现油珠。
②停止加热,继续搅拌,冷却片刻后,从冷凝管上口慢慢加入适量饱和亚硫酸氢钠溶液,并将反应混合物趁热过滤,用少量热水洗涤滤渣。合并滤液和洗涤液,于冰水浴中冷却,然后用浓盐酸酸化至苯甲酸析出完全。将析出的苯甲酸过滤,用少量冷水洗涤,放在沸水浴上干燥。称量,粗产品为1.0 g。
③纯度测定:称取0. 122 g粗产品,配成乙醇溶液,于100 mL容量瓶中定容。每次移取25. 00 mL溶液,用0.01000 mol·L−1的KOH标准溶液滴定,三次滴定平均消耗21. 50 mL的KOH标准溶液。
回答下列问题:
-
(1) 根据上述实验药品的用量,三颈烧瓶的最适宜规格为______(填标号)。A . 100 mL B . 250 mL C . 500 mL D . 1000 mL
-
(2) 在反应装置中应选用冷凝管(填“直形”或“球形”),当回流液不再出现油珠即可判断反应已完成,其判断理由是。
-
(3) 加入适量饱和亚硫酸氢钠溶液的目的是;该步骤亦可用草酸在酸性条件下处理,请用反应的离子方程式表达其原理。
-
(4) “用少量热水洗涤滤渣”一步中滤渣的主要成分是。
-
(5) 干燥苯甲酸晶体时,若温度过高,可能出现的结果是。
-
(6) 本实验制备的苯甲酸的纯度为;据此估算本实验中苯甲酸的产率最接近于(填标号)。
A.70% B.60% C.50% D.40%
-
(7) 若要得到纯度更高的苯甲酸,可通过在水中的方法提纯。
[查阅资料] ①BCl3的熔点为-107.3 ℃,沸点为12.5 ℃;②2B+6HCl  2BCl3↑+3H2↑;③硼与铝的性质相似,也能与氢氧化钠溶液反应。
2BCl3↑+3H2↑;③硼与铝的性质相似,也能与氢氧化钠溶液反应。
[设计实验] 某同学设计如图所示装置制备三氯化硼:

请回答下列问题:
-
(1) 常温下,可用高锰酸钾与浓盐酸发生的反应可替代A装置中的反应,请写出高锰酸钾与浓盐酸反应的离子方程式: 。
-
(2) E装置的作用是。如果拆去B装置,可能的后果是。
-
(3) 三氯化硼遇水剧烈反应生成硼酸(H3BO3)和白雾,写出该反应的化学方程式。实验室保存三氯化硼的注意事项是。
-
(4) 实验中可以用一个盛装(填试剂名称)的干燥管代替F和G装置,使实验更简便。
-
(5) 为了顺利完成实验,正确的操作是(填序号)。
①先点燃A处酒精灯,后点燃D处酒精灯 ②同时点燃A、D处酒精灯 ③先点燃D处酒精灯,后点燃A处酒精灯
-
(6) 请你补充完整下面的简易实验,以验证制得的产品中是否含有硼粉:取少量样品于试管中,滴加浓(填化学式)溶液,若有气泡产生,则样品中含有硼粉;若无气泡产生,则样品中无硼粉。

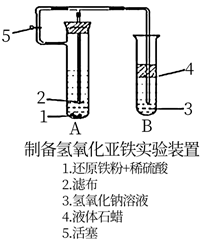
-
(1) 在B试管中加入NaOH溶液后加热煮沸1—2分钟立即加入2mL液体石蜡,该操作目的是。
-
(2) 在具支试管A中加入稀H2SO4溶液和略微过量的铁粉,分析为什么铁粉过量。
-
(3) 连接好导管,同时打开活塞,当铁粉与稀硫酸反应平稳时,关闭活塞,这时A试管中的现象为,原因是。B试管中现象为。
 溶液
C . 用二硫化碳清洗残留在试管壁上少量的硫粉
D . 用苯萃取溴水中的溴时,有机层从分液漏斗的下口放出
溶液
C . 用二硫化碳清洗残留在试管壁上少量的硫粉
D . 用苯萃取溴水中的溴时,有机层从分液漏斗的下口放出
|
|
|
|
A.洗气 | B.干燥气体 | C.用水吸收NH3 | D.排空气法收集H2 |

选项 | a中的物质 | b中的物质 | c中收集的气体 | d中的物质 |
A | 浓氨水 |
|
|
|
B | 浓硫酸 |
|
|
|
C | 稀硝酸 |
|
|
|
D | 浓盐酸 |
|
|
|







 溶液
溶液