实验1-1 蓝瓶子实验 知识点题库
 B . 比较两种物质的热稳定性
B . 比较两种物质的热稳定性 C . 实验室制取NH3
C . 实验室制取NH3 D . 分离沸点不同且互溶的液体混合物
D . 分离沸点不同且互溶的液体混合物
 B .
B . 
 B .
B .  C .
C .  D .
D . 

-
(1) 装置A的名称为。向三颈烧瓶中加入溶液之前,应先从右侧导管中通入氮气,目的是。
-
(2) 水合肼可用含NaOH 的NaClO溶液氧化尿素[CO(NH2)2]溶液制得,反应的化学方程式为。
-
(3) 制备水合肼时,分液漏斗应盛装(填标号)。理由是。
a.NaOH 和NaClO 混合溶液
b.CO(NH2)2 溶液
-
(4) 弱酸性条件下水合肼可处理电镀废水,将Cr2O72-还原为Cr(OH)3沉淀而除去,水合肼被氧化为N2 , 该反应的离子方程式为。常温下Ksp[Cr(OH)3]= 10-32 , 且当溶液中离子浓度小于10-5mol/L时可视作沉淀完全。则Cr3+沉淀完全时,溶液的pH=。
-
(5) 有同学认为该实验收集装置有缺陷。请你写出改进措施:。
-
(1) 采用下图装置制取Na2S2O5 , 装置Ⅲ中有Na2S2O5晶体析出。

①装置Ⅰ中盛放浓硫酸的仪器名称为;滴加浓硫酸前需要将装置內的空气排净,这样操作的目的是。
②装置Ⅱ的作用之一是观察SO2的生成速率,其中的液体最好选择。
a.蒸馏水
b.饱和Na2SO3溶液
c.饱和NaHSO3溶液
d.饱和NaHCO3溶液
③从装置Ⅲ中分离出Na2S2O5晶体可采取的操作方法是;裝置Ⅳ的作用是,盛装的试剂为。
-
(2) 将0.5mol Na2S2O5溶于水配成1L溶液,测得该溶液pH=4.5,溶液中部分微粒浓度随溶液酸碱性变化的情况如图所示。

①写出上述条件下Na2S2O5溶解于水时与水反应的化学方程式;
②结合溶液中的离子平衡的知识解释溶液显酸性的原因。
-
(3) 检验Na2S2O5晶体在空气中已被氧化的实验方案是。
-
(4) 葡萄酒常用Na2S2O5作抗氧化剂,葡萄酒中抗氧化剂的残留量通常是以游离SO2的含量计算,我国国家标准(GB2760—2014) 规定葡萄酒中SO2的残留量≤0.25g/L。该研究小组测定某葡萄酒中抗氧化剂的残留量(以游离SO2计算) 的方案如下:

(已知:滴定时反应的化学方程式为SO2+I2+2H2O=H2SO4+2HI)
按上述方案进行实验,消耗标准I2溶液20.00mL,该次实验测得样品中抗氧化剂的残留量为g·L-1 , 该数据说明某葡萄酒中SO2的残留量 (填“是”或“否”)达到我国国家标准。
A | B | C | D |
酒精 | 氢气 | 浓硫酸 | 氢氧化钠 |
|
|
|
|
-
(1) 从草木灰中提取钾盐的实验操作顺序如下:①称量样品,②溶解沉降,③,④,⑤冷却结晶。
-
(2) 用托盘天平(指针向上的)称量样品时,若指针偏向右边,则表示________(填字母)。A . 左盘重,样品轻 B . 左盘轻,砝码重 C . 右盘重,砝码轻 D . 右盘轻,样品重
-
(3) 在进行②③④操作时,都要用到玻璃棒,其作用分别是:②;③;④。
-
(4) 将制得的少量晶体放入试管,加蒸馏水溶解并把溶液分成三份,分装在3支试管里。
①在第一支试管里加入稀盐酸,可观察有生成,证明溶液中有离子。
②在第二支试管里加入足量稀盐酸后,再加入BaCl2溶液,可观察到有生成,证明溶液中有离子。
③在第三支试管里加入足量Ba(NO3)2溶液,过滤后,再向滤液中加入足量稀硝酸后,再加入AgNO3溶液,可观察到有生成,证明溶液中有离子。

-
(1) 碱浸泡用来除去废旧电池中的,为提高该物质的去除率可采取的措施有(任写两条)。
-
(2) 向“残渣”中加入稀硫酸和H2O2 , 放出大量气泡,写出LiCoO2与H2O2反应的化学方程式:。
-
(3) 设溶液中c(Co2+)=0.1mol⋅L-1 , 为沉淀Co2+ , 向“滤液2”中加入 (NH4)2C2O4 , 而不用Na2C2O4。利用如下数据说明原因:。[已知:25℃时0.1mol/L (NH4)2C2O4溶液pH约为6.4;0.1mol⋅L-1 Na2C2O4溶液pH约为8.35;Ksp[Co(OH)2]=6.0×10−13]
-
(4) H萃取Cu2+的原理可表示为:Cu2++2HR⇌CuR2+2H+。实验室进行萃取实验用到的两种玻璃仪器是、;向有机层中加入反萃取剂
(填化学式)可将Cu2+反萃取至水层。

-
(5) 已知Li2CO3溶解度随着温度变化曲线如图。加入Na2CO3溶液后应进行的操作是。
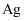 (其它金属忽略不计)的一种工艺流程如图,下列说法错误的是( )
(其它金属忽略不计)的一种工艺流程如图,下列说法错误的是( ) 
已知:  溶液在受热或酸性条件下易分解
溶液在受热或酸性条件下易分解
 ,则可能的化学反应为
,则可能的化学反应为  C . “操作Ⅰ”需用到的玻璃仪器有玻璃棒、烧杯、漏斗
D . “还原”过程中
C . “操作Ⅰ”需用到的玻璃仪器有玻璃棒、烧杯、漏斗
D . “还原”过程中  转化为无害气体
转化为无害气体  ,则理论上消耗
,则理论上消耗  可提取
可提取 
| A | B | C | D |
| | | | |
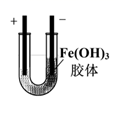
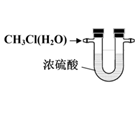
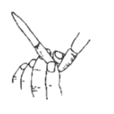
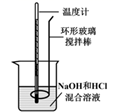
| 电泳实验证明Fe(OH)3胶体粒子带电 | 干燥一氯甲烷气体 | 排除盛有0.100 mol/L盐酸的滴定管中的气泡 | 测定酸碱中和反应的反应热 |

-
(1) 以生成10 mL气体为计时终点。结果如下表所示:
序号

V(稀硫酸)/mL

Ⅰ
1
20
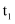
Ⅱ
3
20

①除图示所列举的仪器,为顺利完成该实验,还需要的重要仪器是。
②实验Ⅰ和实验Ⅱ的目的是探究对化学反应速率的影响,
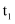 (填“>”“<”或“=”)
(填“>”“<”或“=”) 。
。 -
(2) 下列方法不能使本实验中生成氢气的速率加快的是____(填字母)。A . 将稀硫酸换成浓硫酸 B . 在稀硫酸中滴加少许浓硫酸 C . 在稀硫酸中加入一定量浓硝酸 D . 在稀硫酸中滴加少许硫酸铜溶液
-
(3) 等质量的锌分别与4份50 mL过量的盐酸在不同的实验条件下完全反应,实验数据如下表:
实验组别

反应前温度/℃
金属状态
1
1.0
20
块状
2
1.6
25
块状
3
1.6
30
块状
4
1.6
25
粉末状
①实验(填实验组别序号)可表明实验温度对反应速率产生影响。
②实验2和4表明也可对反应速率产生影响。