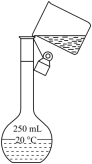
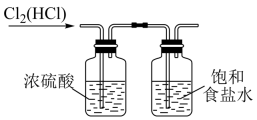
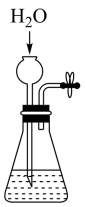
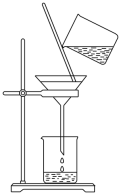
课题一 物质的分离和提纯 知识点题库
①通入足量Cl2 ②将海带焙烧成灰后加水搅拌 ③加CCl4振荡 ④用分液漏斗分液 ⑤过滤 合理的操作顺序是.
海水中含有丰富的化学元素,下面是某化工厂从海水中提取NaCl、Mg(以MgCl2形式存在)和Br2(以NaBr的形式存在)及综合利用的生产流程简图:

回答下列问题:
-
(1) 流程图中操作①的名称为
-
(2) 有同学认为:可直接加热Mg(OH)2得到MgO,再电解熔融的MgO制金属镁,这样可简化实验步骤,体现实验的简约性原则.你 (填“同意”或“不同意”该同学的想法,理由是
-
(3) 该流程图里B、C反应可以生产工业上一重要产品,写出该反应的化学方程式

已知:HCNO的结构式是:H﹣O﹣C≡N
HCN的Ka=6.02×10﹣10
[Ag(CN)2]﹣(aq)⇌Ag+(aq)+2CN﹣(aq) K=1.3×10﹣21
回答下列问题:
-
(1) CN﹣中两原子均为8电子稳定结构,请写出CN﹣的电子式.
-
(2) 氰化钠遇水会产生剧毒氢氰酸,请写出相应的离子方程式.
-
(3) 向发生塔中通水蒸汽的目的是.
-
(4) 氧化池中氰化物的降解分两步进行,CN﹣被氯气氧化成低毒的CNO﹣ , 写出相应的离子方程式,CNO﹣被氯气氧化成无毒的两种气体,写出相应的离子方程式
-
(5) 贮水池中废水须先经碱化后再进行氧化的原因.
-
(6) 电镀厂电镀银时需要降低镀层金属的沉积速度,使镀层更加致密.电解液使用Na[Ag(CN)2],请写出阴极反应式,解释工业电镀中使用氰离子(CN﹣)的原因.
①除去乙烷中少量的乙烯:通入酸性高锰酸钾溶液中;
②除去乙酸乙酯中的乙酸:用饱和碳酸钠溶液洗涤,分液、干燥、蒸馏;
③除去苯中少量的苯酚:加入足量浓溴水后过滤;
④除去乙醇中少量的乙酸:加足量生石灰,蒸馏.
分离方法:A 萃取分液 B分液 C升华 D结晶 E蒸馏 F过滤 G洗气法
-
(1) 分离饱和食盐水与沙子的混合物.
-
(2) 粗盐提纯.
-
(3) 分离水和汽油的混合物.
-
(4) 分离四氯化碳(沸点为76.75℃)和甲苯(沸点为110.6℃)(四氯化碳和甲苯互溶).
-
(5) 提取碘水中的碘.

实验操作可分解为如下几步:
A.把盛有溶液的分液漏斗放在铁架台的铁圈中;
B.静罝,分层;
C.检验分液漏斗活塞和上口的玻璃塞是否漏液;
D.倒转漏斗用力振荡并不时旋开活塞放气,最后关闭活塞,把分液漏斗放正;
E.从分液漏斗上口倒出含碘的CCl4溶液;
F.把50mL碘水和15mL CCl4加入分液漏斗中,并盖好玻璃塞;
G.旋幵活塞,用烧杯接收溶液;
H.将漏斗上口的玻璃塞打开或使塞上的凹槽或小孔对准漏斗口上的小孔.
就此实验,完成下列填空:
-
(1) 该实验的正确操作顺序是;
-
(2) 上述操作步骤中有一步有错误,请指出(填步骤字母编号);
-
(3) 能选用CCl4从碘水中萃取碘的原因是A . CCl4与水不互溶 B . CCl4与碘单质和水都不反应 C . CCl4较常见且常温下是液体 D . I2在CCl4中溶解度大于在水中的溶解度
-
(4) 上述H步骤操作的目的是;
-
(5) B步骤中溶液静置,分层后,溶液下层显色;
-
(6) 从含碘的CCl4溶液中提取碘和回收CCl4 , 还需要经过蒸馏,观察下列实验装置有一处错误请改正:;

-
(7) 装置A中加入碎瓷片的作用 B装置的名称为,锥形瓶接收的物质是.
 B .
B .  C .
C .  D .
D . 
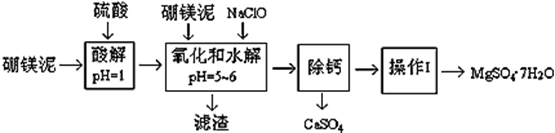
-
(1) 实验中需要1 mol/L的硫酸800 mL,若用 98% 的浓硫酸(ρ= 1.84 g/mL)来配制,量取浓硫酸需要使用量筒的规格为__________(填写选项字母)A . 10 mL B . 20 mL C . 50 mL D . 100 mL
-
(2) 加入的NaClO可与Mn2+ 反应:Mn2+ + ClO‾ + H2O = MnO2↓+ 2H+ + Cl‾,在该步骤中还有一种离子也会被NaClO氧化,该反应的离子方程式为。
-
(3) 滤渣的主要成分除含有Fe(OH)3、Al(OH)3外,还含有。
-
(4) 在“除钙”前,需检验滤液中Fe3+ 是否被除尽,简述检验方法。(写出操作、现象和结论)
-
(5) 已知MgSO4、CaSO4 的溶解度(单位为 g/100 g 水)如下表:
温度(℃)
40
50
60
70
MgSO4
30.9
33.4
35.6
36.9
CaSO4
0.210
0.207
0.201
0.193
“除钙”是将MgSO4和CaSO4混合溶液中的CaSO4除去,根据上表数据,简要说明操作步骤。“操作Ⅰ”是将滤液继续蒸发浓缩,冷却结晶,,便得到了MgSO4∙7H2O
-
(1) 常温时CuSO4的水溶液呈(填“酸”“中”或“碱”)性,原因是(用离子方程式表示。
-
(2) 在实验室配制FeCl3溶液时,常将FeCl3固体先溶于较浓的(填物成名称)中,然后用蒸馏水稀释到所需的浓度,以(填“促进”或“抑制”)其水解。
-
(3) 把AlCl3溶液蒸干、灼烧,最后得到的主要固体产物是(写化学式)。
![]()

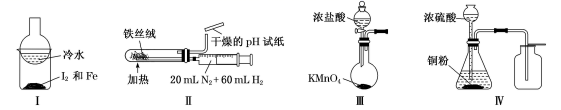
下列说法正确的是( )
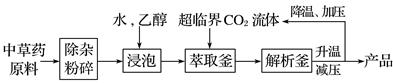
下列说法中错误的是( )
 用于石油工业脱硫与脱色,是一种不溶于水和乙醇的白色粉末,在潮湿空气中可被迅速氧化。实验室用
用于石油工业脱硫与脱色,是一种不溶于水和乙醇的白色粉末,在潮湿空气中可被迅速氧化。实验室用  混合溶液与
混合溶液与  溶液反应制取
溶液反应制取 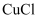 ,相关装置如图。回答以下问题:
,相关装置如图。回答以下问题: 
-
(1) 图甲中仪器B的名称是,制备过程中
 过量会发生副反应生成
过量会发生副反应生成  ,为提高产率,仪器A中所加试剂应为;
,为提高产率,仪器A中所加试剂应为;
-
(2) 丙图是体系pH随时间变化关系图,制取
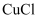 反应的离子方程式为,丁图是产率随pH变化关系图,实验过程中往往用
反应的离子方程式为,丁图是产率随pH变化关系图,实验过程中往往用  混合溶液代替单一
混合溶液代替单一  溶液,其中
溶液,其中  的作用是;
的作用是; 
-
(3) 反应完成后经抽滤、洗涤、干燥获得产品。抽滤装置如图乙所示,抽滤所用的仪器包括布氏漏斗、吸滤瓶、安全瓶和抽气泵。其中抽气泵的作用是使吸滤瓶与安全瓶中的,跟常规过滤相比,采用抽滤的优点是(写一条);洗涤时,用“去氧水”作洗涤剂洗涤产品,作用是。
-
(4)
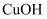 不稳定易分解为
不稳定易分解为  ,
,  时
时 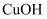 的
的  ,
, 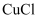 的
的  ,把
,把 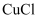 固体和
固体和  溶液混合,加热,得到红色沉淀,该沉淀的化学式为。
溶液混合,加热,得到红色沉淀,该沉淀的化学式为。
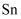 、
、 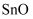 )联合生产氯化亚锡和硫酸亚锡晶体,其工艺流程如下:
)联合生产氯化亚锡和硫酸亚锡晶体,其工艺流程如下: 
已知:①  易水解生成碱式氯化亚锡
易水解生成碱式氯化亚锡  ;②在水溶液中,
;②在水溶液中,  易被氧化为
易被氧化为  。
。
请回答下列问题:
-
(1) 锡在周期表中的位置为。
-
(2) 已知反应I得到的沉淀是
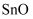 ,产生气体的结构式为,反应的化学方程式为。
,产生气体的结构式为,反应的化学方程式为。
-
(3) 图中滤液的主要成分为、(写化学式)。
-
(4) 酸溶时一般加入浓盐酸进行溶解,请用化学方程式及必要文字解释原因:。
-
(5) 电镀锡渣中的锡与烧碱、硝酸钠溶液反应可生产锡酸钠,并产生一种碱性气体,该反应的化学方程式为。
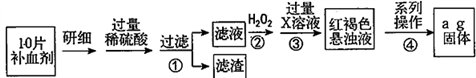
请回答下列问题:
-
(1) 向操作①的滤液中滴加KSCN 溶液后变为红色,则该滤液中含有(填离子符号)。
-
(2) 操作②中反应的离子方程式:。
-
(3) 操作③中反应的离子方程式:。
-
(4) 操作④中一系列处理的操作步骤:过滤、、灼烧、、称量。
-
(5) 假设实验中的损耗忽略不计,则每片补血剂含铁元素的质量为g。(用含a的代数式表示)
物质 | 除杂试剂 | 分离方法 | |
A | NaCl溶液(I2) | CCl4 | 分液 |
B | CH3CH2OH(CH3COOH) | NaOH溶液 | 蒸馏 |
C | HCl(Cl2) | 饱和食盐水 | 洗气 |
D | CaCO3(CaSO4) | Na2CO3溶液 | 过滤 |
 杂质)为原料冶炼铝的工艺流程如图:
杂质)为原料冶炼铝的工艺流程如图:
对上述流程的判断正确的是( )
 效果更佳
B . 试剂X为氨水,目的是除去矿石中的氧化铁杂质
C . 反应Ⅱ的离子方程式为
效果更佳
B . 试剂X为氨水,目的是除去矿石中的氧化铁杂质
C . 反应Ⅱ的离子方程式为 D . Fe和
D . Fe和 可以组成铝热剂,工业上通过铝热反应制备Al,成本更低
可以组成铝热剂,工业上通过铝热反应制备Al,成本更低
A | B | C | D |
|
|
|
|
溶液的配制 | 氯气的净化 | 检查装置的气密性 | 沉淀的过滤 |