课题一 物质的分离和提纯 知识点题库
 干燥Cl2
B .
干燥Cl2
B . 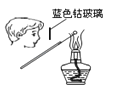 检验K2CO3中的K+
C .
检验K2CO3中的K+
C .  证明氨气极易溶于水
D .
证明氨气极易溶于水
D .  实验室制氨气
实验室制氨气
-
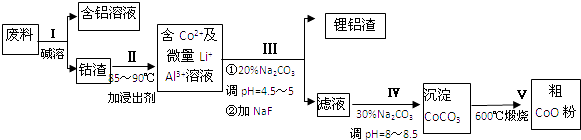
(1) 为了提高废料溶浸的效率,可以采取的措施有(写一条即可)
-
(2) 过程Ⅰ中采用NaOH溶液溶出废料中的Al,反应的离子方程式为.
-
(3) 过程Ⅱ中加入稀H2SO4酸化后,再加入Na2S2O3溶液浸出钴.则浸出钴的化学反应方程式为(产物中只有一种酸根).在实验室模拟工业生产时,也可用盐酸浸出钴,但实际工业生产中不用盐酸,请从反应原理分析不用盐酸浸出钴的主要原因.
-
(4) 过程Ⅲ得到锂铝渣的主要成分是LiF和Al(OH)3 , 请写出产生Al(OH)3反应的离子方程式.
-
(5) 碳酸钠溶液在过程Ⅲ和IV中所起作用有所不同,请写出在过程Ⅳ中起的作用是.
-
(6) 实验室模拟生产过程V中,必须使用的仪器,除酒精灯、三脚架外,还需、.

据此回答下列问题:
-
(1) Ⅰ、Ⅱ、Ⅲ、Ⅳ四步中对于溶液和沉淀的分离采取的方法是.
-
(2) 根据上述框图反应关系,写出下列B、D、E所含物质的化学式
固体B;沉淀D;溶液E和 _.
-
(3) 写出①、②、④三个反应的离子方程式,不是离子反应的写出其化学方程式.
①;②;④.

-
(1) 从氯化钾溶液中得到氯化钾固体,选择装置(填代表装置图的字母,下同);分离CCl4(沸点为76.75℃)和甲苯(沸点为110.6℃)的液体混合物,选择装置,该分离方法的名称为.
-
(2) 从碘水中分离出I2 , 选择装置,该分离方法的名称为,若将碘水和CCl4注入分液漏斗中充分振荡并静置后,碘主要溶解在(填“上层”或“下层”)液体中,该层溶液颜色为.
-
(3) 装置A中①的名称是,进水的方向是从(填“上”或“下”)口进水.装置B在分液时为使液体顺利下滴,应进行的具体操作.
![]()
请回答下列问题:
-
(1) “灼烧”前先将海带用酒精浸润,其目的是。
-
(2) “过滤”时除了烧杯外还需使用的玻璃仪器有。
-
(3) ①从环保角度及产物中不引人新的杂质方面考虑,“氧化”时最适合加入的氧化剂是 (填标号)。
A.氯气 B.硝酸 C.H2O2
②若使用上述选中的氧化剂在酸性条件下氧化,则发生反应的离子方程式为。
-
(4) 上述流程中涉及的实验操作不包括下列选项中的 (填标号)。A .
 B .
B .  C .
C .  D .
D . 
-
(5) 请设计一个简单的实验方案,检验加入CCl4萃取碘后的水层中是否还含有碘单质:。
由于苯甲酸乙酯的沸点较高,很难蒸出,所以本实验采用加入环己烷的方法,使环己烷、乙醇和水形成三元共沸物,其沸点为62.1℃。三元共沸物经过冷凝回流形成两相,其中环己烷在上层的比例大,再流回反应瓶;水在下层的比例大,放出下层即可除去反应生成的水。
装置图:

|
试剂 |
相对分子质量 |
密度/(g/cm3) |
沸点/℃ |
在水中的溶解性 |
|
乙醇 |
46 |
0.7893 |
78.5 |
易溶 |
|
苯甲酸 |
122 |
1.2659 |
249 |
微溶 |
|
环己烷 |
84 |
0.7785 |
80 |
难溶 |
|
乙醚 |
74 |
0.7318 |
34.51 |
难溶 |
|
苯甲酸乙酯 |
150 |
1.05 |
211 ~ 213 |
微溶 |
实验步骤:
①加料:在50 mL圆底烧瓶中加入6.1 g苯甲酸、13 mL乙醇、10 mL环己烷、2.0 mL浓硫酸,摇匀,加沸石。按照装置图左图组装好仪器(安装分水器,分水器上端接一冷凝管) ,从分水器上端小心加水至分水器支管处,然后再放去一部分 水使液面离分水器支管口约0.5 cm。
②分水回流:将烧瓶在水浴上加热回流,开始时回流速度要慢。随着回流的进行,分水器中出现了上、中、下三层液体。当中、下层接近分水器支管时,将中、下层液体放入量筒中。
③中和:将反应液倒入盛有30 mL水的烧杯中,分批加入碳酸钠粉末至溶液呈中性(或弱碱性),无二氧化碳逸出,用pH试纸检验。
④分离萃取、干燥、蒸馏:用分液漏斗分出有机层,将水层溶液用25 mL乙醚萃取,然后合并至有机层。用无水MgSO4干燥,对粗产物进行蒸馏,低温蒸出乙醚。当温度超过140℃时,直接接收一定温度下的馏分,得产品约5.7 mL。
回答下列问题:
-
(1) 反应容器中制取苯甲酸乙酯的化学方程式为,装置图中仪器A的名称是。
-
(2) 本实验采取了多种措施来提高酯的产率,请写出其中两种。
-
(3) 在制备苯甲酸乙酯时,加入环己烷的作用是。
-
(4) 步骤3中和时,加入碳酸钠粉末要分批的原因是。
-
(5) 用乙醚萃取后要把(填字母序号)的液体合并至有机层。
a.从分液漏斗下部流出的 b.从分液漏斗.上口倒出的
-
(6) 步骤4收集馏分应控制的最佳温度范围为℃。本实验的产率为 (保留小数点后1位)。

-
(1) 装置Ⅱ中冷凝管除导气外,还有的作用,冷凝水从口进入(填“a或“b”)。四个实验装置中能起到防倒吸的装置有(填序号)。
-
(2) 实验开始时,关闭K2 , 开启K1和滴液漏斗活塞,滴加苯和液溴的混合液,反应开始,写出装置Ⅱ中发生的主要有机化学反应的化学方程式,反应类型为,能说明苯与液溴发生的是此反应类型的现象是。Ⅲ中小试管内苯的作用是。
-
(3) 反应结束后,要让装置I中的水倒吸入装置Ⅱ中。这样操作的目的是。
-
(4) 三颈烧瓶内反应后的液体呈棕黄色,将依次进行下列实验操作就可得到较纯净的溴苯。
①用蒸馏水洗涤,振荡,分液;
②用5%的NaOH溶液洗涤,振荡,分液;
③用蒸馏水洗涤,振荡,分液;
④加入无水CaCl2粉末干燥;
⑤通过(填操作名称),可得到无色的较纯净的溴苯。
 的铜器放入盐酸中浸泡,除去铜绿
B . 将铜丝插入浓硫酸中并加热,反应后再加入水,观察硫酸铜溶液的颜色
C . 将
的铜器放入盐酸中浸泡,除去铜绿
B . 将铜丝插入浓硫酸中并加热,反应后再加入水,观察硫酸铜溶液的颜色
C . 将 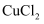 溶液在蒸发皿中加热蒸干,得到无水
溶液在蒸发皿中加热蒸干,得到无水 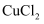 固体
D . 常温下将铜丝伸入盛满氯气的集气瓶中,观察
固体
D . 常温下将铜丝伸入盛满氯气的集气瓶中,观察 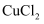 的生成
的生成
| 编号 | 物质(或溶液) | 杂质 | 除杂试剂 | 操作方法 |
| A | NaCl | CaCl2 | 过量Na2CO3溶液 | 过滤 |
| B | CO2 | O2 | 铜网 | 通过灼热的铜网 |
| C | FeSO4 | CuSO4 | 过量铝粉 | 过滤 |
| D | CO2 | CO | 点燃 |
 常用于配制金属缓蚀剂。图为利用钼精矿(主要成分是
常用于配制金属缓蚀剂。图为利用钼精矿(主要成分是 , 含少量PbS等)为原料生产钼酸钠晶体的工艺流程图。
, 含少量PbS等)为原料生产钼酸钠晶体的工艺流程图。
回答下列问题:
-
(1)
 中钼元素的化合价是;
中钼元素的化合价是;
-
(2) “焙烧”反应为
 , 该反应氧化产物是(填化学式),写出一条提高焙烧速率的措施;
, 该反应氧化产物是(填化学式),写出一条提高焙烧速率的措施;
-
(3) “浸取”时含钼化合物发生反应的离子方程式为;
-
(4) “结晶”前需向滤液中加入
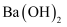 固体以除去
固体以除去 。若滤液中
。若滤液中 ,
,  , 要使钼元素无损失,残余
, 要使钼元素无损失,残余 的最低浓度是mol/L;[已知:
的最低浓度是mol/L;[已知: ,
,  ]
]
-
(5) 钼酸钠也可用钼酸铵
 和适量热的纯碱反应来制取,反应后溶液中只含钼酸钠从而有利于提纯。该反应的化学方程式为;
和适量热的纯碱反应来制取,反应后溶液中只含钼酸钠从而有利于提纯。该反应的化学方程式为;
-
(6) 钼酸钠和月桂酰肌氨酸的混合液常作为碳素钢的缓蚀剂。常温下,碳素钢在缓蚀剂中的腐蚀速率实验结果如图所示。

要使碳素钢的缓蚀效果最好,缓蚀剂中钼酸钠(摩尔质量为M)的物质的量浓度为mol/L。

已知:常温下,ZrCl4是白色固体, 604K升华,遇水强烈水解:ZrCl4+9H2O=ZrOCl2·8H2O+2HCl,在浓盐酸中会析出ZrOCl2·8H2O沉淀。请回答下列问题:
-
(1) “高温气化”中可发生多个反应,写出发生的主要反应的化学方程式是。
-
(2) 分馏过程中,为防止产品变质,过程中一定需要注意的是。液体a的电子式是。
-
(3) 实验室中洗涤ZrOCl2·8H2O沉淀操作是。
-
(4) “还原”中氧化剂是(填化学式)。
-
(5) 由于锆铪(Hf)矿石共生,这样制得的锆中常含有少量的铪,需要进一步分离提纯。
第一步:溶解分离
将样品溶于氢氟酸后再加入一定量KOH溶液,锆和铪均以[MF6]2-存在。
①已知在水中K2HfF6比K2ZrF6的溶解度大,且K2ZrF6的溶解度随温度的升高而增大,可以利用
方法进行分离。
②离子交换法:利用强碱型酚醛树脂R-N(CH3)
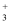 Cl-阴离子交换剂进行交换分离,原理是:2RN(CH3)3Cl+K2ZrF6= [RN(CH3)3]ZrF6+2 KCl;2RN(CH3)3Cl+K2HfF6=[RN(CH3)3]HfF6+2 KCl。然后再用HF和HCl混合溶液为淋洗剂,先后将这两种阴离子淋洗下来,达到分离的目的。这种方法能够将锆、铪分离的原因是。
Cl-阴离子交换剂进行交换分离,原理是:2RN(CH3)3Cl+K2ZrF6= [RN(CH3)3]ZrF6+2 KCl;2RN(CH3)3Cl+K2HfF6=[RN(CH3)3]HfF6+2 KCl。然后再用HF和HCl混合溶液为淋洗剂,先后将这两种阴离子淋洗下来,达到分离的目的。这种方法能够将锆、铪分离的原因是。③将所得溶液与有机相磷酸三丁酯(TBP)充分混合、振荡,可以达到Zr与Hf分离。这种分离方法是。
第二步:高温还原
在高温条件下,加入铝将制得的K2ZrF6还原可得锆,反应的化学方程式是。
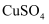 C .
C .  D .
D . 
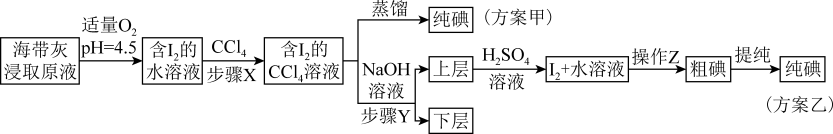
已知:3I2+6NaOH=5NaI+NaIO3+3H2O;酸性条件下,I2在水中的溶解度很小。
回答下列问题:
-
(1) 灼烧海带实验用到的主要仪器有酒精灯、三脚架、泥三角、玻璃棒、等。
-
(2) “适量O2”也可以用双氧水替代,酸性条件下双氧水氧化碘离子的离子方程式为。
-
(3) 上述方案乙中,“含I2的水溶液”经三步转化为含“I2+水溶液”,主要目的是。
-
(4) 步骤X中,萃取后分液漏斗内观察到的现象是。
-
(5) 下列有关步骤Y的说法中正确的是____(填标号)A . 主要是除浸取原液中的有机杂质 B . 将碘转化成离子进入水层 C . 应控制NaOH溶液的浓度和体积 D . NaOH溶液可由乙醇代替
-
(6) 方案甲中采用蒸馏分离效果不佳,原因是;方案乙中操作Z的名称是。

 的方法制备金属铝
B . 生产纯硅的过程中涉及到的化学反应都是氧化还原反应
C . 黄铜矿冶炼铜时,副产物
的方法制备金属铝
B . 生产纯硅的过程中涉及到的化学反应都是氧化还原反应
C . 黄铜矿冶炼铜时,副产物 可用于生产硫酸,
可用于生产硫酸,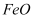 可用作冶炼铁的原料
D . 硅是光导纤维、太阳能电池和计算机芯片的重要材料
可用作冶炼铁的原料
D . 硅是光导纤维、太阳能电池和计算机芯片的重要材料



