课题一 物质的分离和提纯 知识点题库
二氧化锰是制造锌锰干电池的基本材料.工业上以软锰矿为原料,利用硫酸亚铁制备高纯二氧化锰的流程如下:

某软锰矿的主要成分为MnO2 , 还含有Si(16.27%)、Fe(5.86%)、Al(3.42%)、Zn(2.68%)和Cu(0.86%)等元素的化合物.部分阳离子以氢氧化物或硫化物的形式完全沉淀时溶液的pH见下表,回答下列问题:
沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 | Cu(OH)2 | Zn(OH)2 | CuS | ZnS | MnS | FeS |
pH | 5.2 | 3.2 | 9.7 | 10.4 | 6.7 | 8.0 | ≥﹣0.42 | ≥2.5 | ≥7 | ≥7 |
-
(1) 硫酸亚铁在酸性条件下将MnO2还原为MnSO4 , 酸浸时发生的主要反应的化学方程式为
-
(2) 滤渣A的主要成分是
-
(3) 加入MnS的目的是除去 杂质.
-
(4) 碱性锌锰电池中,MnO2参与的电极反应方程式为
-
(5) 从废旧碱性锌锰电池中可以回收利用的物质有 (写两种)

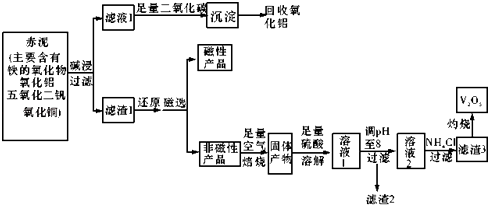
已知:I.钒有多种价态,其中+5价最稳定.钒在溶液中主要以VO2+和VO3﹣的形式存在,存在平衡VO2++H2O⇌VO3﹣+2H+ .
Ⅱ.部分含钒物质在水中的溶解性如下表所示:
|
物质 |
V2O5 |
NH4VO3 |
(VO2)2SO4 |
|
溶解性 |
难溶 |
难溶 |
易溶 |
Ⅲ.部分离子的沉淀pH值:
|
|
Cu2+ |
Fe2+ |
Fe3+ |
|
开始沉淀pH值 |
5.2 |
7.6 |
2.7 |
|
完全沉淀pH值 |
6.4 |
9.6 |
3.7 |
请回答下列问题:
-
(1) 碱浸步骤中最好选用.
a.NaOH溶液b.氨水 c.纯碱溶液
-
(2) 写出滤液1与足量二氧化碳反应的离子方程式.
-
(3) 磁选步骤得到的磁性产品为.
-
(4) 溶液1到溶液2的过程中,调节pH值至8有两个目的,一是除去铜离子,二是使.
-
(5) 滤渣3的主要成分为,工业上常用铝热反应法由V2O5冶炼金属钒,请写出反应的化学方程式.

-
(1) “反应2”的还原剂是,写出它的电子式,该反应的化学方程式为,原因是。
-
(2) 采取“减压蒸发”而不用“常压蒸发”,原因是。
-
(3) 从“母液”中可回收的主要物质是。
-
(4) “冷却结晶”后经(填操作名称)即可获得粗产品。
选项 | 物质(杂质) | 除杂质所用试剂及方法 |
A | 乙醇(水) | 加入生石灰蒸馏 |
B | 苯(苯酚) | 加入浓溴水振荡后过滤 |
C | 溴乙烷(溴单质) | 加入NaHSO3溶液振荡、静置、分液 |
D | 甲烷(乙烯) | 依次通过KMnO4酸性溶液、NaOH溶液洗气 |

资料:
物质 | 铟(In) | 锡(Sn) |
周期表位置 | 第五周期、第IIIA族 | 第五周期、第IVA族 |
颜色、状态 | 银白色固体 | 银白色固体 |
与冷酸作用 | 缓慢反应 | 缓慢反应 |
与强碱溶液 | 不反应 | 反应 |
-
(1) 为了加快步骤①的反应速率,可以采取的措施有(至少答两点)。
-
(2) 步骤①中铟的氧化物转化成In3+的离子方程式是。
-
(3) 步骤②中加入过量铟能够除去溶液中的Sn2+ , 根据所给资料分析其原因是。
-
(4) 步骤④和⑤中NaOH溶液的作用是。
-
(5) 下图是模拟精炼铟的装置图,请在方框中填写相应的物质。


回答下列问题:
-
(1) 物质B的名称为;
-
(2) 将此实验分离得到的NaCl,经分析含杂质是因为上述方法中某一步设计的错误,请写出错误的这一步正确的设计方案:
-
(3) 写出上述过程中所涉及的化学反应方程式:
-
(4) 若实验结束时,称量得到的NaCl固体的质量为17.55g,CaCl2固体的质量为11.1g,则原混合物中NaCl和CaCl2的物质的量之比为。

| 选项 | 气体 | a | b | c |
| A | SO2 | 浓硫酸 | Na2SO3 | NaOH溶液 |
| B | H2 | 稀硫酸 | 锌片 | 浓硫酸 |
| C | CO2 | 稀盐酸 | 石灰石 | 碱石灰 |
| D | NO2 | 浓硝酸 | 铜粉 | 浓硫酸 |


完成下列填空:
-
(1) 粗盐水加入沉淀剂A、B除杂质(沉淀剂A来源于石灰窑厂),写出A、B的化学式。A,B。
-
(2) 碳酸化后过滤,滤液D最主要的成分是(填写化学式),检验这一成分的阴离子的具体方法是:。
-
(3) 该工艺流程中可回收再利用的物质是。
-
(4) 产品纯碱中含有碳酸氢钠,如果取m1kg纯碱加热分解后剩余固体质量为m2kg,纯碱中碳酸氢钠的质量分数可表示为:。

回答下列问题:
-
(1) 盛放浓盐酸的仪器名称是,a中的试剂为。
-
(2) c中采用冰水冷却方式的目的是,c中化学反应的离子方程式是。
-
(3) d的作用是,可选用试剂(填标号)。
A Na2SO3 B NaCl C Ca(OH)2 浊液 D H2SO4
-
(4) 反应结束后,取出b中试管,经冷却结晶,,,干燥,得到KClO3晶体。
-
(5) 取少量KClO3和NaClO溶液分别置于1号和2号试管中,滴加中性KI溶液。1号试管溶液颜色不变。2号试管溶液变为棕色,滴入少量CCl4溶液显紫色,请写出该反应的离子方程式 。
 ,还含有
,还含有  、
、 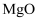 、
、  等杂质。工业上利用铬铁矿制备
等杂质。工业上利用铬铁矿制备  晶体的工艺流程如下图所示。
晶体的工艺流程如下图所示。 
下列说法正确的是( )
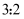 B . “滤渣1”的主要成分为
B . “滤渣1”的主要成分为 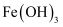 、
、 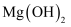 C . 通
C . 通  调
调  发生的化学反应仅有
发生的化学反应仅有  D . 试剂
D . 试剂  可以为稀
可以为稀 
相关物质性质:
物质名称 | 相对分子质量 | 颜色、状态 | 溶解性 | 沸点/℃ | 毒性 |
苯乙腈 | 117 | 无色油状液体,密度比水大 | 难溶于水,溶于醇 | 233.5 | 有毒 |
氯化苄 | 126.5 | 无色或微黄色的透明液体 | 微溶于水,混溶于乙醇 | 179.4 | 有毒 |
氰化钠 | 49 | 白色结晶颗粒或粉末 | 易溶于水 | 1496 | 剧毒 |
二甲胺 | 45 | 无色气体,高浓度有类似氨的气味 | 易溶于水,溶于乙醇 | 6.9 | 有毒 |
反应原理:![]() (氯化苄)+NaCN
(氯化苄)+NaCN
![]() (苯乙腈)+NaCl
(苯乙腈)+NaCl
主要装置:

实验步骤:
①向仪器a中加入氯化苄25.3g,缓慢加入适量二甲胺水溶液,放入磁子搅拌。
②安装好球形冷凝管、恒压漏斗及温度计,开启冷凝水,并对仪器a进行加热至90℃。
③向恒压漏斗中加入30%氰化钠水溶液49.0g。
④控制滴加速度与反应温度,使反应在90±5℃下进行。
⑤滴加结束后,加热回流20小时。
⑥反应结束并冷却至室温后,向混合物中加100mL水,洗涤,分液。
⑦往得到的粗产物中加入无水CaCl2颗粒,静置片刻,倒入蒸馏烧瓶中,弃去CaCl2 , 进行减压(2700Pa)蒸馏,收集115~125℃馏分,得到产品无色透明液体22.3g。
回答下列问题:
-
(1) 图中仪器a的名称是,倒置漏斗的作用是。若反应中缺少二甲胺,相同条件下几乎没有产品得到,说明二甲胺在反应中起到的作用。
-
(2) 反应温度控制在90±5℃的原因可能是。加热回流时冷凝水应从(填“b”或“c”)口进入冷凝管。
-
(3) 进行分液操作时产品在混合物(填“上层”或“下层”),分液时的具体操作为将分液漏斗放置在铁架台铁圈上静置至油、水层分层且界面清晰,。
-
(4) 无水CaCl2颗粒的作用是。
-
(5) 在蒸馏过程中,减压蒸馏得到的产品纯度和产率均比常压下蒸馏收集233℃馏分高,原因是。
-
(6) 本实验所得到的苯乙腈产率是(保留三位有效数字)。
-
(1) I.海水是巨大的资源宝库,海水淡化及其综合利用具有重要意义。

请回答下列问题:
请列举除蒸馏法外海水淡化的一种方法:。
-
(2) 步骤I中,粗盐中含有Ca2+、Mg2+、
 等杂质离子,精制时常用的试剂有:①稀盐酸;②氯化钡溶液;③氢氧化钠溶液;④碳酸钠溶液。下列加入试剂的顺序正确的是____(填字母)。
A . ①②③④ B . ②③④① C . ②④③① D . ③④②①
等杂质离子,精制时常用的试剂有:①稀盐酸;②氯化钡溶液;③氢氧化钠溶液;④碳酸钠溶液。下列加入试剂的顺序正确的是____(填字母)。
A . ①②③④ B . ②③④① C . ②④③① D . ③④②① -
(3) 步骤II已经获得Br2 , 步骤III又将Br2还原为Br- , 其目的是。
-
(4) 写出步骤III反应的离子方程式:。
-
(5) II.海洋植物如海带、海藻中含有丰富的碘元素。碘元素以碘离子的形式存在。实验室从海带中提取碘的流程如下:

灼烧所用仪器有酒精灯、泥三角、(填仪器名称)。
-
(6) 向酸化的滤液中加入过氧化氢溶液,可将I-氧化为I2;请写出该反应的离子方程式:。



