实验2-1 纸上层析分离甲基橙和酚酞 知识点题库
-
(1) 该学生的操作(填“正确”或“错误”),其理由是;
-
(2) 如不正确请说明理由,同时请分析是否一定有误差?;
-
(3) 若用此方法分别测定c(OH﹣)相等的氢氧化钠溶液和氨水的pH,误差较大的是,原因是;
-
(4) 只从下列试剂中选择实验所需的试剂,你能否区分0.1mol•L﹣1硫酸溶液和0.01mol•L﹣1硫酸溶液?,简述操作过程..
试剂:A.紫色石蕊试液B.酚酞试液C.甲基橙溶液D.蒸馏水E.氯化钡溶液F.pH试纸.
步骤1:称量4.66g草酸铁晶体进行处理后,配制成250 mL一定物质的量浓度的溶液。
步骤2:取所配溶液25.00 mL于锥形瓶中,加稀H2SO4酸化,滴加KMnO4溶液至草酸根
恰好全部氧化成二氧化碳,同时MnO4-被还原成Mn2+。向反应后的溶液中加入一小匙锌粉,加热至溶液黄色刚好消失,过滤、洗涤,将过滤及洗涤所得溶液收集到锥形瓶中,此时溶液仍呈酸性。
步骤3:用0.0200 mol·L-1KMnO4溶液滴定步骤2所得溶液至终点,消耗KMnO4溶液V1 mL,滴定中MnO4-被还原成Mn2+。
重复步骤2、步骤3的操作2次,分别滴定消耗0.0200 mol·L-1 KMnO4溶液为V2、V3 mL。
记录数据如下表:
实验编号 | KMnO4溶液的浓度(mol·L-1) | KMnO4溶液滴入的体积(mL) |
1 | 0.0200 | V1 = 20.02 |
2 | 0.0200 | V2 = 20.12 |
3 | 0.0200 | V3 = 19.98 |
请回答下列问题:
-
(1) 草酸铁溶液能做净水剂的原因(用离子方程式表示)
-
(2) 该实验步骤1和步骤3中使用的仪器除托盘天平、铁架台、滴定管夹、烧杯、玻璃棒外,一定需用下列仪器中的 (填序号)
A.酸式滴定管 B.碱式滴定管 C.量筒(10 mL) D.锥形瓶 E.胶头滴管 F.漏斗 G.250 mL容量瓶
-
(3) 加入锌粉的目的是
-
(4) 步骤3滴定时是否选择指示剂(是或否);说明理由写出步骤3中发生反应的离子方程式
-
(5) 在步骤2中,若加入的KMnO4溶液的量不够,则测得的铁含量(填“偏低”、“偏高”或“不变”);实验测得该晶体中结晶水的个数x为。
-
(1) Ⅰ.某同学进行影响草酸与酸性高锰酸钾溶液反应速率因素的研究。室温下,两支试管分别编号①和②,实验数据如下:
实验序号
①
②
③
加入试剂
4 mL 0.01mol/L
酸性 KMnO4溶液
2 mL 0.1mol/L
H2C2O4溶液
4 mL 0.01mol/L
酸性 KMnO4溶液
2 mL 0.1mol/L H2C2O4溶液
一粒黄豆粒大的MnSO4固体
4 mL 0.01mol/L
酸性 KMnO4溶液
2 mL 0.1mol/L H2C2O4溶液
一粒黄豆粒大的Na2SO4固体
褪色时间/s
116
6
试管①中KMnO4溶液褪色的速率开始十分缓慢,一段时间后突然加快。
请回答:
草酸与酸性高锰酸钾的反应的离子方程式为:
-
(2) 实验①②结论是。
-
(3) 实验②选用MnSO4固体而不是MnCl2固体的原因是。
-
(4) 该同学为使实验更加严密,在试管③中做了如下实验,请预测褪色时间约为。
-
(5) Ⅱ.滴定法是一种重要的定量分析方法,应用范围很广。某地市场上销售的一种食用精制盐包装袋上有如下部分说明:
产品等级
一级
配料
食盐、碘酸钾(KIO3)、抗结剂
碘含量(以I计)
20~50 mg·kg-1
已知:IO3-+5I-+6H+ = 3I2+3H2O,I2+2S2O32- = 2I-+S4O62-某学生拟测定食用精制盐的碘含量,其步骤为
a.准确称取W g食盐,加适量蒸馏水使其完全溶解
b.用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全
c.加入指示剂,逐滴加入物质的量浓度为2.0×10-3 mol·L-1的Na2S2O3溶液10.0 mL,恰好反应完全
c中加入的指示剂可选用,恰好完全反应时的现象是。
-
(6) 若操作b在空气中振荡时间过长,则最终测定的测定食用精制盐中的的碘含量会(填“偏高”、“偏低”或“没有影响”)。
-
(7) 根据以上实验和包装说明,算得所测食用精制盐的碘含量是(以含W的代数式表示)mg·kg-1(计算结果保留整数即可)。
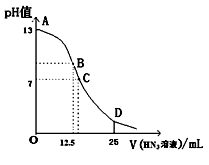
①取一定量的粗CuO,加入过量浓盐酸,加热并搅拌,充分反应后过滤,溶液的pH为1。
②向滤液中通入Cl2 , 搅拌。
③向②中加入适量物质A,微热,搅拌,调整溶液的pH,过滤。
④把③所得滤液浓缩。
-
(1) ①中加热并搅拌的目的是。
-
(2) ②中发生反应的离子方程式是。
-
(3) ③中的物质A可能是;调整的pH范围是;过滤后滤渣的成分是。
-
(4) ③中发生反应的离子方程式是。
-
(5) ①③中如何用pH试纸测定溶液的pH值:。
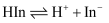 , 其分子、离子为不同颜色。下表是酚酞在pH不同的溶液中的结构和变色规律。下列说法中错误的是( )
, 其分子、离子为不同颜色。下表是酚酞在pH不同的溶液中的结构和变色规律。下列说法中错误的是( )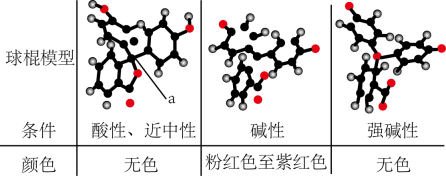
(图中环状结构为苯环)
 杂化转化为
杂化转化为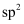 杂化
C . 当指示剂的
杂化
C . 当指示剂的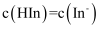 , 则
, 则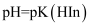 , 此时的pH为理论变色点
D . 温度改变,指示剂的变色范围可能发生改变
, 此时的pH为理论变色点
D . 温度改变,指示剂的变色范围可能发生改变



