实验2-1 纸上层析分离甲基橙和酚酞 知识点题库
 B .
B .  C .
C .  D .
D . 
A.用pH试纸测定Na2CO3溶液的pH
B.从氯酸钾和二氧化锰制取氧气的剩余固体中提取KCl
C.实验室用新制的FeSO4溶液和预处理过的NaOH溶液制备Fe(OH)2白色沉淀
D.配制一定物质的量浓度的氯化钠溶液
E.取某溶液做焰色反应实验,说明该溶液中含有钠元素
F.用适量的蔗糖、浓硫酸和水在小烧杯中进行浓硫酸的脱水性实验
G.促使过饱和的硝酸钾溶液析出晶体.
绪言课上,老师在滤纸上用酚酞溶液画漫画,然后再喷洒某种液体X,滤纸上立即显示出红色图象.则X可能是( )

①滴有石蕊的H2SO4溶液 ②滴有酚酞的氨水溶液
③滴有酚酞的氢氧化钠溶液 ④滴有酚酞的饱和氢氧化钙溶液
⑤滴有酚酞的Na2CO3溶液 ⑥溶有SO2的品红溶液.
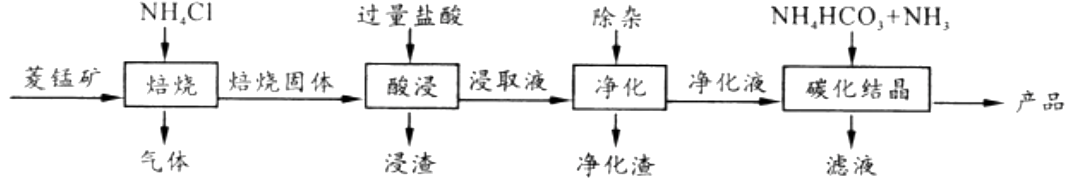
已知:MnCO3+2NH4Cl  MnCl2 +CO2 ↑+2NH3 ↑+H2O↑
MnCl2 +CO2 ↑+2NH3 ↑+H2O↑
-
(1) 焙烧时温度对锰浸取率的影响如图。
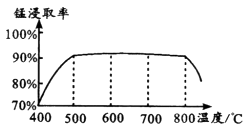
焙烧时适宜温度为;800℃以上锰的浸取率偏低,可能原因是。
-
(2) 净化包含三步: ①加入少量MnO2 , 反应的离子方程式为;
②加氨水调pH,生成沉淀主要是;
③加入NH4F,除去Ca2+、Mg2+。
-
(3) 碳化结晶中生成MnCO3的离子方程式为。
-
(4) 滴定法测产品纯度
I 取固体产品1.160 g 于烧杯中,加入过量稀H2SO4充分振荡,再加入NaOH 溶液至碱性,发生反应2Mn2+ +O2 +4OH-=2MnO(OH)2;
II 加入过量KI 溶液和适量稀H2SO4 , 发生反应:MnO(OH)2 +2I-+4H+=Mn2+ + I2 +3H2O;
III 取I中混合液的1/10于锥形瓶中,加入淀粉溶液作指示剂,用0.1000 mol/LNa2S2O3溶液进行滴定,发生反应:2S2O32-+I2=S4O62-+2I- , 滴定终点时消耗Na2S2O3溶液20.00 mL。
①判断滴定终点的方法是。
②假设杂质不参与反应,则产品纯度为。

-
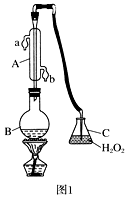
(1) 仪器A的名称是,水通入A的进口为。
-
(2) B中加入300.00 mL葡萄酒和适量盐酸,加热使SO2全部逸出并与C中H2O2完全反应,其化学方程式为。
-
(3) 除去C中过量的H2O2 , 然后用0.090 00 mol·L-1NaOH标准溶液进行滴定,滴定前排气泡时,应选择图2中的;
若滴定终点时溶液的pH=8.8,则选择的指示剂为;
若用50 mL滴定管进行实验,当滴定管中的液面在刻度“10”处,则管内液体的体积(填序号)(①=10 mL,②=40 mL,③<10 mL,④>40 mL )。
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 将NaOH溶液逐滴滴加到AlCl3溶液中至过量 | 先产生白色胶状沉淀,后沉淀溶解 | Al(OH)3是两性氢氧化物 |
| B | NaHCO3溶液与NaAlO₂溶液混合 | 生成白色沉淀 | 结合H+的能力:CO32->AlO2- |
| C | 向盛有Na2SiO3 , 溶液的试管中滴加1滴酚酞,然后逐滴加入稀盐酸至过量 | 试管中红色逐渐褪去,出现白色凝胶 | 非金属性:Cl>Si |
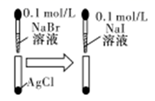
| D | | 白色固体先变为淡黄色,后变为黄色 | 溶度积常数:Ksp(AgCl)>Ksp(AgBr)>Ksp(AgI) |
-
(1) 酸碱中和滴定——用标准盐酸滴定未知浓度的NaOH溶液,下列操作造成测定结果偏高的是 (填选项字母)
A.滴定终点读数时,俯视滴定管刻度,其他操作符合题意。
B.盛装未知液的锥形瓶用蒸馏水洗过,未用未知液润洗
C.酸式滴定管用蒸馏水洗净后,未用标准盐酸润洗
D.滴定前,盛装标准液的滴定管尖嘴有气泡,滴定后气泡消失
-
(2) 氧化还原滴定——取一定量的草酸溶液置于锥形瓶中,加入适量稀硫酸,用浓度为0.1mol·L-1的高锰酸钾溶液滴定,表格中记录了实验数据:
滴定次数
待测液体积
(mL)
标准KMnO4溶液体积(mL)
滴定前读数
滴定后读数
第一次
25.00
0.50
20.40
第二次
25.00
3.00
23.00
第三次
25.00
4.00
24.10
①滴定时发生的离子反应方程式,KMnO4溶液应装在 (填“酸”或“碱”)式滴定管中,滴定终点时滴定现象是。
②该草酸溶液的物质的量浓度为。
-
(3) 沉淀滴定――滴定剂和被滴定物的生成物比滴定剂与指示剂的生成物更难溶。参考下表中的数据,若用AgNO3滴定NaSCN溶液,可选用的指示剂是______(填选项字母)。
难溶物
AgCl
AgBr
AgCN
Ag2CrO4
AgSCN
颜色
白
浅黄
白
砖红
白
Ksp
1.77×10-10
5.35×10-13
1.21×10-16
1.12×10-12
1.0×10-12
A . NaCl B . NaBr C . NaCN D . Na2CrO4
 的含量。先将部分变质的烧碱配制成一定浓度溶液并加入一种指示剂,用一定浓度的HCl溶液滴定至变色后,再加入另一种指示剂,继续用该HCl溶液滴定至变色,分别记录两个变色点加入HCl溶液体积进行计算。滴定过程中溶液pH的变化如图所示。下列说法错误的是( )
的含量。先将部分变质的烧碱配制成一定浓度溶液并加入一种指示剂,用一定浓度的HCl溶液滴定至变色后,再加入另一种指示剂,继续用该HCl溶液滴定至变色,分别记录两个变色点加入HCl溶液体积进行计算。滴定过程中溶液pH的变化如图所示。下列说法错误的是( ) 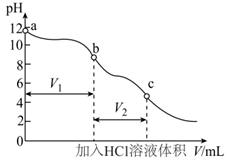
 C . 若
C . 若  ,则a点溶液中存在
,则a点溶液中存在 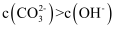 D . 原固体混合物中碳酸钠的质量分数表示为
D . 原固体混合物中碳酸钠的质量分数表示为 
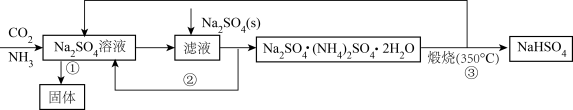
某化学兴趣小组在实验室中根据上述流程进行模拟实验。流程中①中的反应实验装置图(待完善)如下。 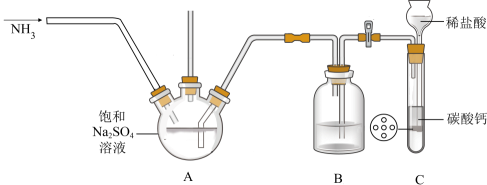
请回答:
-
(1) 流程中反应①后所获固体主要成分是(用化学式表示)。写出反应③生成NaHSO4的化学反应方程式。
-
(2) 装置图中B的作用是。
-
(3) 实验时持续通NH3 , 但A中产生少量固体后便不再继续反应,此时B、C中可能观察到的现象是。
-
(4) 下列说法中错误的是____。A . 反应②能生成复盐Na2SO4·(NH4)2SO4·2H2O的主要原因是其溶解度较小 B . 抽滤过程中应注意观察吸滤瓶内液面高度,当快达到吸滤瓶支管口时,应拔掉吸滤瓶上的橡皮管,从吸滤瓶支管口倒出溶液 C . 依据该流程闭路循环绿色的特点,“煅烧(350℃)”的实验中最好用稀硫酸处理尾气 D . 装置图A中的长玻璃导管下端应浸入溶液中,作用是作为安全管 E . 利用该流程制备两种盐的总反应方程式为Na2SO4+CO2+H2O=NaHSO4+NaHCO3
-
(5) 测定NaHSO4的纯度:称取一定质量所得产品配成250mL溶液,用移液管取出15.00mL,用NaOH标准溶液滴定。
①实验过程中,移液管洗涤干净并用蒸馏水清洗2~3次后,进行的后续一系列操作如下。
a.吸取少量待取液润洗2~3次
b.将润洗好的移液管插入待取溶液底部,吸取溶液使液面至标线以上
c.松动食指使液面缓慢下降至溶液的凹液面与标线相切,立即按紧管口
d.用吸水纸吸净尖端内、外的残留水
e.将润洗好的移液管插入待取溶液液面下约1-2cm处,吸取溶液使液面至标线以上
f.将移液管提出液面,倾斜容器,将管尖紧贴容器内壁成约45°角,稍待片刻
g.拿掉洗耳球,立即用食指堵住管口,使液体不再流出
h.当溶液流尽后,再停数秒,并将移液管向左右转动一下,取出移液管
i.将移液管垂直放入稍倾斜的锥形瓶中,并使管尖与容器内壁接触,松开食指使溶液全部流出
请选择正确操作的编号,按顺序排列:→→→g→f→→→(序号不重复)
②为使实验结果更加精确,滴定过程中最好选用下列指示剂中的哪一种。
A.甲基橙 B.石蕊 C.酚酞