实验3-3 植物体中某些元素的检验 知识点题库
-
(1)
工业上可用酸性刻蚀废液(主要成分有Cu2+、Fe2+、Fe3+、H+、Cl−)制备碱式碳酸铜,其制备过程如下:
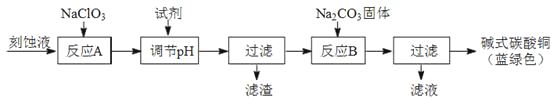
已知:Cu2+、Fe2+、Fe3+生成沉淀的pH如下:
物质
Cu(OH)2
Fe(OH)2
Fe(OH)3
开始沉淀pH
4.2
5.8
1.2
完全沉淀pH
6.7
8.3
3.2
①氯酸钠的作用是;
②反应A后调节溶液的pH范围应为。
③第一次过滤得到的产品洗涤时,如何判断已经洗净?。
④造成蓝绿色产品中混有CuO杂质的原因是。
-
(2)
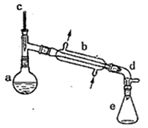
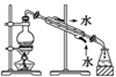
某学习小组在实验室中利用下图所示装置制取氯气并探究其性质。
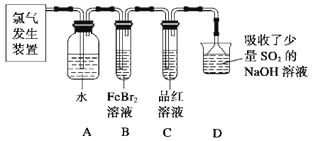
①实验室用二氧化锰和浓盐酸加热制取氯气,所用仪器需要检漏有。
②若C中品红溶液褪色,能否证明氯气与水反应的产物有漂白性,说明原因。此时B装置中发生反应的离子方程式是。
③写出A溶液中具有强氧化性微粒的化学式。若向A溶液中加入NaHCO3粉末,会观察到的现象是。
物质 | Cu(OH)2 | Fe(OH)3 | CuCl | CuI |
Ksp | 2.2×10﹣20 | 2.6×10﹣39 | 1.7×10﹣7 | 1.3×10﹣12 |
现有某酸性CuCl2溶液中含有少量的FeCl2 , 为得到纯净的CuCl2•2H2O晶体,按如图步骤进行提纯:

-
(1) 最适合作氧化剂X的是(填字母),加入X的目的是.
A.K2Cr2O7 B.NaClO C.H2O2 D.KMnO4
加入的物质Y是(填化学式),调至溶液pH=4,使溶液中的Fe3+转化为Fe(OH)3沉淀,此时溶液中的c(Fe3+)=.过滤后,将所得滤液低温蒸发、浓缩结晶,可得到CuCl2•2H2O晶体.
-
(2) 某学习小组用“间接碘量法”测定含有CuCl2•2H2O晶体的试样(不含能与I﹣发生反应的氧化性杂质)的纯度,过程如下:取0.36g试样溶于水,加入过量KI固体,充分反应,生成白色沉淀.用0.1000mol•L﹣1Na2S2O3标准溶液滴定,到达滴定终点时,消耗Na2S2O3标准溶液20.00mL.(I2+2S2O32﹣═S4O62﹣+2I﹣)
①可选用作滴定指示剂.②CuCl2溶液与KI反应的离子方程式为.
③该试样中CuCl2•2H2O的质量百分数为.
(注:Al(OH)3和Cu(OH)2开始分解的温度分别为450℃和80℃)
-
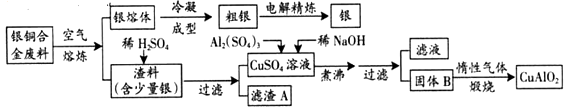
(1) 固体混合物B的组成为;在生成固体B的过程中,需控制NaOH的加入量,若NaOH过量,则因过量引起的反应的离子方程式为。
-
(2) 完成煅烧过程中一个反应的化学方程式:。
-
(3) 若银铜合金中铜的质量分数为64%,理论上5.0kg废料中的铜可完全转化为CuAlO2 , 至少需要1.0mol·L-1的Al2(SO4)3溶液 L。
-
(4) 某同学用FeCl3溶液吸收H2S,得到单质硫;过滤后,再以石墨为电极,在一定条件下电解滤液。
①FeCl3与H2S反应的离子方程式为。
②电解池中H+在阴极放电产生H2 , 阳极的电极反应为。
③综合分析实验II的两个反应,可知该实验有两个显著优点:
H2S的原子利用率100%;。
选项 | A | B | C | D |
实验 目的 | 鉴别盐酸、NaCl溶液、Ca(OH)2溶液 | 鉴别CaCO3和K2CO3粉末 | 除去氯化钠溶液中的少量盐酸 | 除去CaO中的少量CaCO3 |
方案1 | 滴加碳酸钠溶液 | 滴加盐酸 | 滴加适量Na2CO3溶液 | 加足量的水 |
方案2 | 分别测定溶液的pH | 加水 | 滴加适量Ca(OH)2溶液 | 滴加适量盐酸 |
| 选项 | A | B | C | D |
| 实验 | 分离植物油和氯化钠溶液 | 除去氯化钠固体中混有的碳酸钙固体 | 分离CCl4中的Br2 | 除去CO2气体中的HCl气体 |
| 装置或仪器 | | | | |
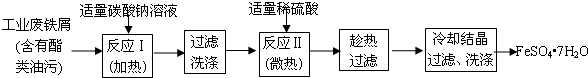
-
(1) 碳酸钠溶液能除去酯类油污,是因为(用离子方程式表示),反应Ⅰ需要加热数分钟,其原因是。
-
(2) 废铁屑中含氧化铁,反应II的离子方程式,判断反应II完成的现象是: 。

-
(1) B的化学式。
-
(2) 加过量A的原因是,有关反应的化学方程式为;。
-
(3) 加过量B的原因是,有关反应的化学方程式为;。
| 物质(杂质) | 检验试剂 | 除杂试剂 | 除杂方法 | |
| A | HCl(Cl2) | 湿润的淀粉-KI试纸 | 饱和NaCl溶液 | 洗气 |
| B | Al(Fe) | 盐酸 | NaOH溶液 | 过滤 |
| C | CO(SO2) | 品红溶液 | 酸性KMnO4溶液 | 洗气 |
| D | CuCl2(FeCl3) | NaOH溶液 | Cu | 过滤 |
 、
、  、
、  、
、  和
和  ,取该溶液
,取该溶液 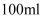 ,加入过量
,加入过量  ,加热,得到
,加热,得到 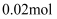 气体,同时产生红褐色沉淀、过滤、洗涤,灼烧,得到
气体,同时产生红褐色沉淀、过滤、洗涤,灼烧,得到 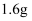 固体;向上述滤液中加足量
固体;向上述滤液中加足量  溶液,得到
溶液,得到 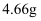 沉淀,由此可知( )
沉淀,由此可知( )
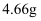 沉淀可能溶于盐酸
D .
沉淀可能溶于盐酸
D . 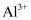 一定不存在
一定不存在
| 实验 | 操作 | |
| A | 浓盐酸与MnO2共热制备纯净Cl2 | 将气体产物依次通过浓硫酸、饱和食盐水 |
| B | 除去甲烷中的乙烯 | 将混合气体通过酸性高锰酸钾溶液 |
| C | 配制氯化铁溶液 | 将氯化铁固体溶解在适量的热水中 |
| D | 分离用CCl4萃取碘水中的I2后的混合物 | 先从分液漏斗下口放出有机层,后从上口倒出水层 |
可能用到的有关数据如下:
| 相对分子质量 | 密度/(g·cm-3) | 沸点/℃ | 溶解性 | |
| 环己醇 | 100 | 0.9618 | 161 | 微溶于水 |
| 环己烯 | 82 | 0.8102 | 83 | 难溶于水 |
按下列实验步骤回答问题:
-
(1) Ⅰ.产物合成:在a中加入10.0g环己醇和2片碎瓷片,冷却搅拌下慢慢加入1mL浓硫酸,b中通入冷却水后,开始缓慢加热a,控制馏出物的温度接近90℃。
碎瓷片的作用是;
-
(2) a中发生主要反应的化学方程式为;
-
(3) 本实验最容易产生的有机副产物的结构简式为。
-
(4) Ⅱ.分离提纯:将反应粗产物倒入分液漏斗中,依次用少量5%碳酸钠溶液和水洗涤,分离后加入无水氯化钙颗粒,静置一段时间后弃去氯化钙,最终通过操作X得到纯净的环己烯,称量,其质量为6.15g。
用碳酸钠溶液洗涤的作用是,操作X的名称为。
-
(5) Ⅲ.产物分析及产率计算:
①核磁共振氢谱可以帮助鉴定产物是否为环己烯,环己烯分子中有种不同化学环境的氢原子。
②本实验所得环己烯的产率是。
已知:  +H2O
+H2O
回答下列问题:
-
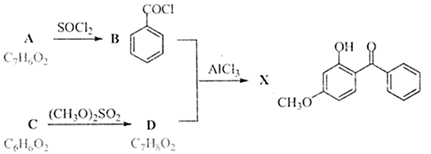
(1) A为单一官能团化合物,其中含氧官能团名称为。C具有两个相同官能团,C的化学名称为。X的分子式为。
-
(2) 鉴别A和D可以选用的试剂为(填序号)。
①NaOH溶液 ②FeCl3溶液 ③NaHCO3溶液
-
(3) 醛E的核磁共振氢谱显示吸收峰面积为3:2:2:1,写出E的结构简式为。F生成饱和一元醇G的反应类型为,G中含有个手性碳(注:连接四个各不相同的基团和原子的碳)。
-
(4) 写出饱和一元醇G与乙酸生成H的化学方程式。
-
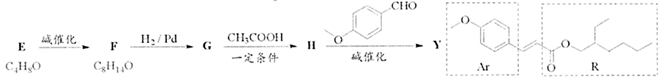
(5) Y吸收紫外线后形成双聚体
 等多种异构体,请指出这样的双聚体共有种(不考虑手性异构)。
等多种异构体,请指出这样的双聚体共有种(不考虑手性异构)。
| 目的 | 方案设计 | 现象或结论 | |
| A | 探究浓度对速率的影响 | 用两支试管各取 | 两试管溶液均褪为无色,且加 |
| B | 探究反应: | 取少量 | 置于热水中的溶液呈蓝色,置于冰水中的溶液呈粉红色,则正反应为吸热反应 |
| C | 纸层析法分离 | 将点有试样点的滤纸条末端浸入展开剂中(试样点未接触展开剂),一段时间后取出滤纸条进行氨熏 | 滤纸表面有红棕色(上)和蓝色(下)斑痕,说明 |
| D | 制备铜氨纤维 | 将脱脂棉加入铜氨溶液,搅拌使之形成黏稠液,用注射器将黏稠液注入稀NaOH溶液中。 | 取出生成物,用水洗涤得到白色的铜氨纤维 |
 废水和工业废气(主要含N2、CO2、SO2、NO、CO,不考虑其他成分),设计了如下流程:
废水和工业废气(主要含N2、CO2、SO2、NO、CO,不考虑其他成分),设计了如下流程: 
下列说法正确的是( )
 废水时,发生的反应为:
废水时,发生的反应为:  +5
+5  +4H+=6NO↑+4H2O
+4H+=6NO↑+4H2O
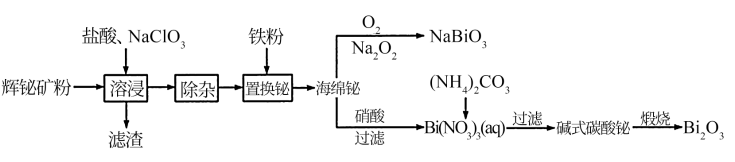
已知:①Bi2O3能溶于酸;②碱式碳酸铋的化学组成:(BiO)2CO3;
③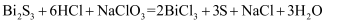 。
。
请回答下列问题:
-
(1) 滤渣的成分有(填化学式,下同);“溶浸”时可能产生一种有毒气体单质,它是。
-
(2) “溶浸”时浸出速率与温度的关系如图所示。
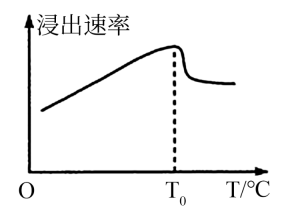
温度高于T0℃时,浸出速率突然减小的原因是。
-
(3) 若将“置换铋”的反应设计成原电池,则负极反应式为。
-
(4) 写出“煅烧”中反应的化学方程式:。
-
(5) 实验室常用下列方法鉴别Mn2+:在硫酸酸化的MnSO4溶液中加入NaBiO3粉末(难溶于水),溶液变成紫红色,还原产物为Bi3+ , 该反应的离子方程式为。
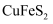 , 含少量
, 含少量 )和软锰矿(主要成分是
)和软锰矿(主要成分是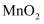 , 含少量
, 含少量 )为原料制备纳米材料MnO和
)为原料制备纳米材料MnO和 的工艺如下:
的工艺如下: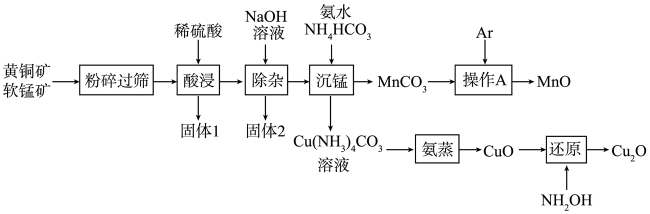
已知:MnO易被氧化。
请回答下列问题:
-
(1) “粉碎过筛”的目的是;“固体1”的主要成分除S外,还有(填化学式)。
-
(2) “除杂”时除掉的离子为(填离子符号)。
-
(3) “沉锰”时生成
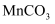 的离子方程式为。
的离子方程式为。
-
(4) 在实验室完成“操作A”时,Ar的作用是。
-
(5) “蒸氨”时发生的是(填“氧化还原反应”或“非氧化还原反应”);“还原”时,每生成1mol
 , 消耗mol
, 消耗mol (
( 被氧化为
被氧化为 )。
)。
-
(6) 已知黄铜矿中硫元素的质量分数为a%,杂质中不含硫元素和铜元素。wkg这种黄铜矿经上述转化最终得到bg
 , 则铜的提取率为%(填含a、b、w的表达式)。
, 则铜的提取率为%(填含a、b、w的表达式)。注:
 。
。
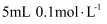 酸性
酸性  溶液,分别加入5滴
溶液,分别加入5滴  和5滴
和5滴 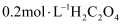 溶液
溶液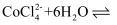
 的热效应
的热效应 于试管中,逐滴加浓盐酸至晶体完全溶解,再滴加水至溶液呈紫色。将紫色溶液分装于三支试管中,分别置于热水、冰水和室温下
于试管中,逐滴加浓盐酸至晶体完全溶解,再滴加水至溶液呈紫色。将紫色溶液分装于三支试管中,分别置于热水、冰水和室温下 和
和 



