实验3-3 植物体中某些元素的检验 知识点题库
某强酸性溶液X中可能含有Fe2+、Al3+、NH4+、CO32-、SO32-、SO42-、Cl-中的若干种,现取X溶液进行连续实验,实验过程及产物如下:
下列说法正确的是
-
(1) 除去混入NaCl溶液中少量NaHCO3杂质的试剂是,离子方程式为.
-
(2) 除去FeCl2溶液中混入的FeCl3溶液杂质用试剂是,离子方程式为.
-
(3) 除去Mg粉中混有的少量Al杂质的试剂是,离子方程式为.
-
(4) 除去NaHCO3溶液中混有的少量Na2CO3杂质的试剂是,离子方程式为.
物质 | 熔点/℃ | 沸点/℃ | 密度/g•cm﹣3 | 溶解性 |
乙二醇 | ﹣11.5 | 198 | 1.11 | 易溶于水和乙醇 |
丙三醇 | 17.9 | 290 | 1.26 | 能跟水、酒精以任意比互溶 |
请用下图所示的仪器分离以上各混合液,仪器和方法不能对应的是( )
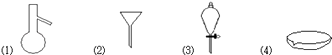
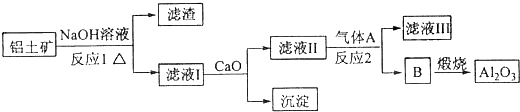
回答下列问题:
-
(1) 写出反应1的化学方程式;
-
(2) 滤液Ⅰ中加入CaO生成的沉淀是;
-
(3) 工业生产中通入的气体A应过量,理由是;则反应2生成B的离子方程式为.
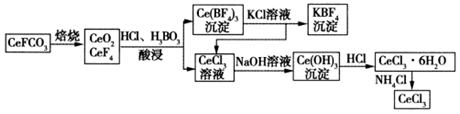
请回答下列问题:
-
(1) CeCO3F中,Ce元素的化合价为.
-
(2) 酸浸过程中用稀硫酸和H2O2替换HCl不会造成环境污染.写出稀硫酸、H2O2与CeO2反应的离子方程式:.
-
(3) 向Ce(BF4)3中加入KCl溶液的目的是.
-
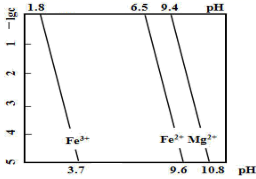
(4) 溶液中的C(Ce3+)等于1×10﹣5mol•L﹣1 , 可认为Ce3+沉淀完全,此时溶液的pH为.
(已知KSP[Ce(OH)3]=1×10﹣20)
-
(5) 加热CeCl3•6H2O和NH4Cl的固体混合物可得到无水CeCl3 , 其中NH4Cl的作用是.
-
(6) 准确称取0.7500gCeCl3样品置于锥形瓶中,加入适量过硫酸铵溶液将Ce3+氧化为Ce4+ , 然后用0.1000mol•l﹣1(NH4)2Fe(SO4)2标准溶液滴定至终点,消耗25.00mL标准溶液.(已知:Fe2+Ce4+═Ce3++Fe3+)
①该样品中CeCl3的质量分数为.
②若使用久置的(NH4)2Fe(SO4)2标准溶液进行滴定,测得该CeCl3样品的质量分数(填“偏大”、“偏小”或“无影响”)
-
(1) 除去乙烷中混有的少量乙烯,所用的试剂是;
-
(2) 除去混在硝基苯中的硝酸,所用的试剂是;
-
(3)
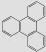 的一氯取代物有种
的一氯取代物有种
-
(4) 2,3﹣二甲基﹣4﹣乙基己烷 (写出结构简式).

-
(1) 沉淀A的主要成分是(填化学式).
-
(2) 操作①的名称是:.
-
(3) 在向溶液1中通入过量的二氧化碳时,①反应剩余的NaOH和过量的CO2发生了化学反应,请写出该反应的化学方程式.
-
(4) 步骤③中反应的离子方程式是.
-
(5) 操作④的名称是:,用到的仪器有玻璃棒、火柴、酒精灯、带铁圈的铁架台和.
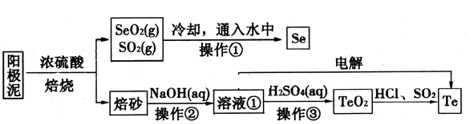
已知:I.TeO2是两性氧化物、微溶于水;
Ⅱ.元素碲在溶液中主要以Te4+、TeO32-、HTeO3-等形式存在;
-
(1) SeO2与SO2通入水中反应的化学方程式为操作①的名称为。
-
(2) 焙砂中碲以TeO2形式存在。溶液①中的溶质主要成分为NaOH、。工业上通过电解溶液①也可得到单质碲。已知电极均为石墨,则阴极的电极反应式为。
-
(3) 向溶液①中加入硫酸,控制溶液的pH为4.5~5.0,生成TeO2沉淀。如果H2SO4过量,将导致碲的回收率偏低,其原因是。
-
(4) 将纯净的TeO2先溶于盐酸得到四氯化碲溶液,然后将SO2通入到溶液中得到Te单质。由四氯化碲得到Te单质的离子方程式为。
 CO(NH2)2·H2O2。过氧化尿素的部分性质如下:
CO(NH2)2·H2O2。过氧化尿素的部分性质如下: | 分子式 | 外观 | 热分解温度 | 熔点 | 溶解性 |
| CO(NH2)2·H2O2 | 白色晶体 | 45℃ | 75~85℃ | 易溶于水、有机溶剂 |
合成过氧化尿素的流程及反应装置图如图:

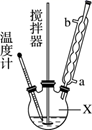
请回答下列问题:
-
(1) 仪器X的名称是,冷凝管中冷却水从 (填“a”或“b”)口出来。
-
(2) 该反应的温度控制30℃而不能过高的原因是。
-
(3) 步骤①宜采用的操作是______ (填字母)。A . 加热蒸发 B . 常压蒸发 C . 减压蒸发
-
(4) 若实验室制得少量该晶体,过滤后需要用冷水洗涤,具体的洗涤操作是。
-
(5) 准确称取1.000g产品于250mL锥形瓶中,加适量蒸馏水溶解,再加2mL6mol·L-1H2SO4 , 用0.2000mol·L-1KMnO4标准溶液滴定至终点时消耗18.00mL(尿素与KMnO4溶液不反应),则产品中CO(NH2)2·H2O2的质量分数为(保留四位有效数字)。若滴定后俯视读数,则测得的过氧化尿素含量(填“偏高”“偏低”或“不变”)。
-
(1) X与Z的化合物
 与水反应转移的电子数为。
与水反应转移的电子数为。
-
(2) 用Y的某化合物可检查输送液态W单质的管道是否泄露,其化学方程式为。
-
(3) 检查某常见固体物质为
 的操作为。
的操作为。
-
(4) Q位于周期表的第周期第族,其单质
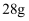 溶于
溶于 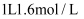 稀硝酸中(只被还原为
稀硝酸中(只被还原为  )的化学方程式为。
)的化学方程式为。
资料显示:
I.pH=2时,NaNO2溶液只能将I- 氧化为I2 , 同时生成 NO
II. I2+5Cl2+6H2O = 2HIO3+10HCl,5  +2
+2  +2H+ = I2+5
+2H+ = I2+5  +H2O
+H2O
-
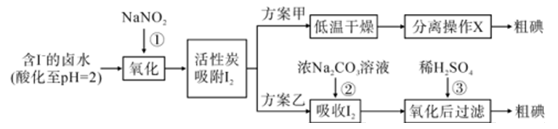
(1) 反应①的离子方程式。
-
(2) 方案甲中,根据I2的特性,分离操作 X 的方法是。
-
(3) 已知:反应②中每吸收3molI2转移5mol电子,离子方程式是。
-
(4) Cl2、酸性 KMnO4 等都是常用的强氧化剂,但该工艺中氧化卤水中的I- 却选择了价格较高的NaNO2 , 原因是。
 溶液可鉴别苯和甲苯
C . 乙酸乙酯中混有的乙酸,可加入足量的
溶液可鉴别苯和甲苯
C . 乙酸乙酯中混有的乙酸,可加入足量的  溶液,经分液除去
D . 将牛油和烧碱溶液混合加热,充分反应后加入热的饱和食盐水,上层析出高级脂肪盐
溶液,经分液除去
D . 将牛油和烧碱溶液混合加热,充分反应后加入热的饱和食盐水,上层析出高级脂肪盐
 、
、  和
和  都是重要的无机化工原料。
都是重要的无机化工原料。
-
(1) 以
 和
和 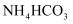 为原料制备
为原料制备  ,并测定产品中少量
,并测定产品中少量  的含量,过程如下:
的含量,过程如下: Ⅰ
 的制备
的制备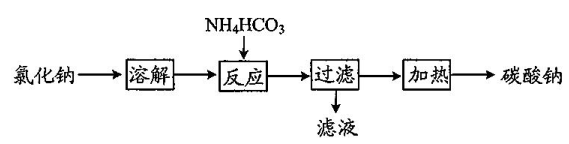
Ⅱ 产品中
 含量的测定
含量的测定步骤1 称取产品
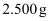 ;溶解,配成
;溶解,配成 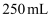 溶液。
溶液。步骤2 取
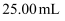 上述溶液,向其中滴入
上述溶液,向其中滴入 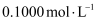 盐酸至
盐酸至 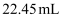 时,溶液中
时,溶液中  恰好完全转化为
恰好完全转化为  。
。步骤3 向步骤 2中溶液继续滴入
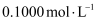 盐酸,又消耗盐酸
盐酸,又消耗盐酸  时,溶液中
时,溶液中  恰好完全转化为
恰好完全转化为  。
。有关盐的溶解度曲线如题图所示。
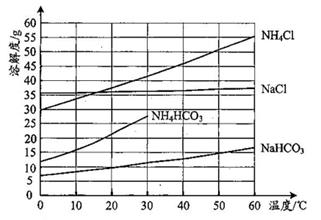
①Ⅰ中“反应”的化学方程式为。
②题图中碳酸氢铵溶解度在
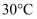 后无数据的原因可能是。
后无数据的原因可能是。③“滤液”中除了
 外,还含有一种阳离子,检验该阳离子的实验方法是。
外,还含有一种阳离子,检验该阳离子的实验方法是。④产品中
 的质量分数为(写出计算过程)。
的质量分数为(写出计算过程)。 -
(2) 精制氯化钠可由海水晒制的粗盐(含有少量
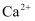 、
、  、
、  等杂质离子)获得。请补充完整由粗盐获得精制氯化钠的实验方案:将粗盐加水溶解,,蒸发结晶,得到精制氯化钠(实验中须用的用品:饱和
等杂质离子)获得。请补充完整由粗盐获得精制氯化钠的实验方案:将粗盐加水溶解,,蒸发结晶,得到精制氯化钠(实验中须用的用品:饱和  溶液、
溶液、  溶液、
溶液、  溶液、盐酸、
溶液、盐酸、  试纸)。
试纸)。
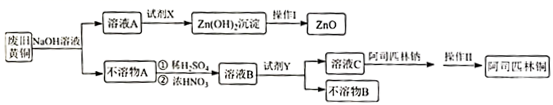
已知:①Zn及化合物的性质与Al及化合物的性质相似。
②阿司匹林铜的消炎作用比阿司匹林强十多倍,它为亮蓝色结晶粉末,不溶于水、醇、醚及氯仿等溶剂,受热不稳定,遇强酸解离为阿司匹林( 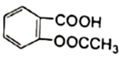 )和Cu2+。
)和Cu2+。
③阿司匹林铜的测定,用Na2S2O3滴定阿司匹林铜与KI生成的I2 , 涉及反应有:
 ;
;  ;
;  。
。
回答下列问题:
-
(1) 废旧黄铜与NaOH溶液反应的终点现象为。
-
(2) 下列有关说法正确的是___________。A . 试剂X为二氧化碳气体、试剂Y为氨水 B . 操作Ⅰ包括过滤、洗涤、干燥、煅烧 C . 上述流程中涉及4次过滤操作 D . 浓HNO3可用O2或H2O2代替
-
(3) 不溶物A制溶液B在如图装置中进行,浓硝酸分多次加入圆底烧瓶中。铜溶解的化学方程式,该装置的缺点有。
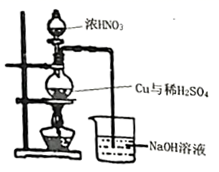
-
(4) 操作Ⅱ,选出获取阿司匹林铜过程中合理的操作并排序。
①依次用蒸馏水、乙醇各洗涤2-3次 ②依次用乙醇、蒸馏水各洗涤2~3次
③小火烘干 ④自然晾干 ⑤蒸发浓缩、冷却结晶 ⑥蒸发结晶 ⑦过滤
-
(5) 阿司匹林钠的制备是用阿司匹林与NaOH溶液反应,为防止阿司匹林水解,通常采用滴定法,请给出指示剂并说明反应完成时的现象。
-
(6) 碘化亚铜会强力吸附碘单质,实验中如果不加入KSCN试剂会使实验结果。(填“偏高”、“偏低”或“无影响”)
-
(1) I.用硫酸铜废液制备PFS

试剂A为。 -
(2) “控温氧化”发生反应的离子方程式为。
-
(3) 测定PFS样品中的n(OH-):取ag样品,溶解于V1mLc1 mol∙L−1HCl溶液中,用KF溶液掩蔽Fe3+(使Fe3+不能与OH-反应),滴入酚酞溶液,再用c2 mol∙L−1NaOH溶液滴定,到达滴定终点时消耗NaOH溶液体积为V2mL。agPFS样品中的n(OH-)=mol。
-
(4) II.用石灰乳-PFS法处理含砷废水

已知:
i.常温下,Ca3(AsO4)2、CaHAsO4的Ksp均大于FeAsO4的Ksp , Fe2(HAsO4)3可溶;
ii.常温下,溶液中含砷微粒的物质的量分数与pH的关系如图。

下列说法错误的是(填序号)。
a.NaH2AsO4溶液的pH<7
b.pH=11.5时,c(H2AsO
 )+2c(HAsO
)+2c(HAsO )+3c(AsO
)+3c(AsO )+c(OH-)=c(H+)
)+c(OH-)=c(H+)c.Na3AsO4溶液中,3c(Na+)=c(AsO
 )+c(HAsO
)+c(HAsO )+c(H2AsO
)+c(H2AsO )+c(H3AsO4)
)+c(H3AsO4) -
(5) “一级沉降”中,石灰乳的作用是。
-
(6) “二级沉降”中,溶液的pH在8~10之间,PFS形成的Fe(OH)3胶体粒子可以通过沉淀反应进一步减少溶液中的As含量,反应的离子方程式为。
-
(7) 溶液的pH和m(Fe)/m(As)对As去除率的影响如图。某酸性含砷废水中As含量为20mg/L,为达到排放标准(As含量≤1mg/L),从节约成本的角度考虑,工业上选择的最佳条件是__(填序号)。
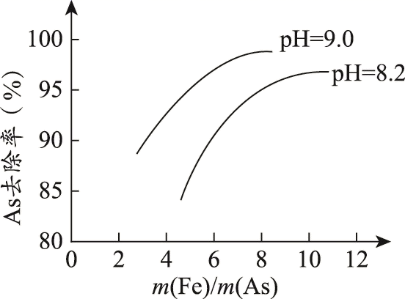
a.pH=8.2m(Fe)/m(As)=5 b.pH=8.2m(Fe)/m(As)=8
c.pH=9.0m(Fe)/m(As)=5 d.pH=9.0m(Fe)/m(As)=8
[m(Fe)/m(As)指PFS中Fe元素质量与对应废水中As元素质量之比]



